题目内容
4.CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如表:| 实验编号 | 温度 | 0 | 10 | 20 | 40 | 50 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
(2)180℃时,反应到40min,体系是(填“是”或“否”)达到平衡状态,理由是温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.可确定40min时反应已经达平衡状态;CH4的平衡转化率为70%.
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值.(写出计算过程)
(4)已知CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1,求算:△H2=-1160kJ/mol.
分析 (1)根据实验1、2的不同点确定实验目的;
(2)根据温度对反应速率的影响判断,转化率=反应的甲烷的量与总的甲烷的量的比;
(3)根据平衡常数定义可知,平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积,据此计算a;
(4)利用盖斯定律计算.
解答 解:(1)实验中只有温度不同,所以实验目的是:研究温度对该化学平衡的影响,
故答案为:研究温度对该化学平衡的影响;
(2)对比实验1知,40时该反应已经达到平衡状态,温度越高,反应速率越大,反应到达平衡的时间越短,所以40时实验2已经达到平衡状态,甲烷的转化率=$\frac{(0.5-0.15)mol}{0.5mol}$=70%,
故答案为:是;温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.可确定40min时反应已经达平衡状态;70%;
(3)设二氧化氮的物质的量为a,
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)
C0(mol/L):0.5 a 0 0 0
△C(mol/L):0.40 0.80 0.40 0.40 0.80
C平(mol/L):0.10 a-0.80 0.40 0.40 0.80
则:$\frac{0.40×0.40×(0.8)^{2}}{0.10×(a-0.80)}$=6.4,a=1.2
答:a的值为1.2;
(4)CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1 ①
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1 ②
将方程式②×2-①得CH4(g)+4NO(g?2N2(g)+CO2(g)+2H2O(g);△H2=(-867kJ•mol-1)×2-(-574kJ•mol-1)=-1160KJ/mol,
故答案为:-1160KJ/mol.
点评 本题考查化学平衡的判断、外界条件对反应速率及化学平衡的影响、盖斯定律等知识点,根据方程式的特点判断平衡移动方向,题目难度中等.

 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案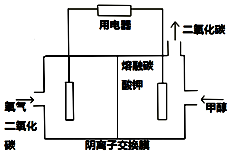 甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.
甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.(1)已知:
①CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H1=a kJ•mol-1
②H2(g)+CO2(g)?H2O(l)+CO(g)△H2=b kJ•mol-1
③CO燃烧热△H3=c kJ/mol
求CO(g)+2H2(g)?CH3OH(g)△H=(2b-a+2c)KJ/mol
(2)在不同的密闭容器中按如下投料方式进行反应:
| 容器编号 | 容器体积/L | 温度/K | CO物质的量/mol | H2物质的量/mol | CH3OH物质的量/mol | 平衡时CO浓度/mol•L-1 | 平衡常数K |
| 1 | 1.0 | 500 | 0.2 | 0.2 | 0 | 0.12 | K1 |
| 2 | 1.0 | 800 | 0.1 | 0 | 0.1 | 0.16 | K2 |
| 3 | 2.0 | 800 | 0.2 | 0.2 | 0 | X | K3 |
①计算800℃时,从反应开始至达到化学平衡,以H2的浓度变化表示的化学反应速率是0.06mol/(L•min),此温度下的平衡常数K=17.36(列出表达式并计算结果,结果保留两位小数)
②下列说法正确的是D
A.X大于0.16
B.当v(CO)正=2v(H2)逆时,反应达到平衡状态
C.平衡后,向容器1中通入0.2mol的CO和0.2mol的H2,再次达到平衡时CO转化率增大
D.K1>K2=K3
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染,而越来越受到关注,如图是一种甲醇燃料电池的工作原理
①写出该燃料电池负极电极反应方程式:CH3OH-6e-+3CO32-=4CO2↑+2H2O
②当电路中有0.6mol电子通过时,需要在正极通入的标况下氧气的体积为3.36L,将生成的气体全部通入2L 0.3mol/L的氢氧化钠溶液中,此时溶液中各离子浓度由大到小顺序为c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+).
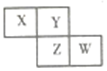 如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )| A. | W的原子序数不可能是X的原子序数的3倍 | |
| B. | Z元素可能为金属 | |
| C. | 四种元素的原子有可能均能与氢原子形成18电子分子 | |
| D. | W的气态氢化物的稳定性一定比Y的强 |
| A. | I2 | B. | Si3N4 | C. | CO2 | D. | Si |
| A. | b g | B. | $\frac{3b}{4}$g | C. | $\frac{b}{2}$g | D. | $\frac{b}{4}$g |
| A. | 酸式滴定管未用盐酸润洗就直接注入标准盐酸 | |
| B. | 滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 | |
| C. | 酸式滴定管在滴定前有气泡,滴定后气泡消失 | |
| D. | 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
| A. | 100ml 0.1mol/L的氯水中通入0.01molSO2气体 | |
| B. | 100ml 0.5mol/L的NaOH中通入0.005mol氯气 | |
| C. | 100ml 0.5mol/L的CuSO4溶液中加入4g NaOH固体 | |
| D. | 100ml自来水中加入0.01mol蔗糖溶解 |
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | + | =1 | - | + | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
| A. | 以上10种元素的原子中,失去核外第一个电子所需能量最少的是⑧ | |
| B. | 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4 | |
| C. | 某元素R的原子半径为1.02×10-10 m,该元素在周期表中位于第三周期第ⅤA族 | |
| D. | 若物质Na2R3是一种含有非极性共价键的离子化合物,则其化合物的电子式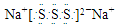 |
 如图所示实验装置可用于制取乙炔.请填空:
如图所示实验装置可用于制取乙炔.请填空: