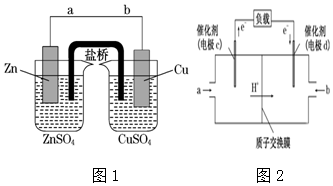
题目内容
6.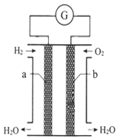 氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )
氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )| A. | 在电池反应中每转移2mol电子,正极消耗O2的体积为11.2L | |
| B. | b极的电极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 工作一段时间后,电解质溶液碱性减弱 | |
| D. | 该装置将化学能转化为电能 |
分析 氢氧燃料碱性电池中,负极上通入燃料,燃料失电子和氢氧根离子反应生成水,正极上通入氧气,氧气得电子和水反应生成氢氧根离子,据此分析解答.
解答 解:A.未指明标准状况,无法计算消耗气体体积,故A错误;
B.b极上氧气得电子生成氢氧根离子,电极反应式为:O2+2H2O+4e-═4OH-,故B正确;
C.该电池的总反应是氢气与氧气反应生成水,溶液的体积增大,氢氧根离子浓度减小,则电解质溶液碱性减弱,故C正确;
D.该装置为原电池装置,将化学能转化为电能,故D正确;
故选A.
点评 本题考查了燃料电池,明确各个电极上发生的反应即可解答,注意电极反应式的书写与溶液酸碱性有关,该燃料电池中,酸性条件下不能生成氢氧根离子、碱性条件下不能生成氢离子,为易错点.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
16.下列操作过程中使溶液导电性变化较大的是 ( )
| A. | 100ml 0.1mol/L的氯水中通入0.01molSO2气体 | |
| B. | 100ml 0.5mol/L的NaOH中通入0.005mol氯气 | |
| C. | 100ml 0.5mol/L的CuSO4溶液中加入4g NaOH固体 | |
| D. | 100ml自来水中加入0.01mol蔗糖溶解 |
17.化学实验中安全意识是重要的学科素养.下列说法正确的是( )
| A. | 凑近集气瓶中闻氯气的气味 | |
| B. | 圆底烧瓶可以用酒精灯直接加热 | |
| C. | 金属钠着火时,用沙子扑灭 | |
| D. | 浓盐酸沾到皮肤上,用氢氧化钠溶液冲洗 |
14.表列出了前20号元素中的某些元素性质的有关数据
下列有关叙述正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | + | =1 | - | + | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
| A. | 以上10种元素的原子中,失去核外第一个电子所需能量最少的是⑧ | |
| B. | 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4 | |
| C. | 某元素R的原子半径为1.02×10-10 m,该元素在周期表中位于第三周期第ⅤA族 | |
| D. | 若物质Na2R3是一种含有非极性共价键的离子化合物,则其化合物的电子式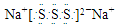 |
1.如图是部分短周期元素原子半径与原子序数的关系如图,则下列说法正确的是( )


| A. | Z、N两种元素形成的化合物熔融状态下可以导电 | |
| B. | X、N两种元素的气态氢化物的沸点相比,前者较低 | |
| C. | Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中 | |
| D. | 由X与M两种元素组成的化合物能与水反应 |
18.关于键长、键能和键角,下列说法不正确的是( )
| A. | 键长越长,键能越小,共价化合物越稳定 | |
| B. | 通过反应物和生成物分子中键能数据可以粗略预测反应热的大小 | |
| C. | 键角是确定多分子立体结构(分子形状)的重要参数 | |
| D. | 同种原子间形成的共价键键长长短总是遵循:叁键<双键<单键 |
15.已知铅蓄电池充放电的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2H2O+2PbSO4,下列关于铅蓄电池的说法正确的是( )
| A. | 在放电时,两极质量均增加 | |
| B. | 在充电时,电池中硫酸的浓度不断变小 | |
| C. | 在放电时,负极发生的反应是 Pb+2e-+SO42-=PbSO4 | |
| D. | 在放电时,正极发生的反应是 PbSO4+2e-=Pb+SO42- |
1.由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如表所示.
①甲在实验之前预计△H1=△H2.他的根据是A、B中酸与碱的元数、物质的量浓度、溶液体积都相同;乙在实验之前预计△H1≠△H2,他的根据是NaOH是强碱,NH3•H2O是弱碱电离吸热.
②实验测得的温度是:A的起始温度为13.0℃、终了温度为19.8℃;设充分反应后溶液的比热容c=4.184J/(g•℃),忽略实验仪器的比热容及溶液体积的变化,则△H1=-56.9kJ/mol.(已知溶液密度均为1g/cm3)
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ•mol-1 |
| A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL | 13.0 | △H1 | |
| B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL | 13.0 | △H2 |
②实验测得的温度是:A的起始温度为13.0℃、终了温度为19.8℃;设充分反应后溶液的比热容c=4.184J/(g•℃),忽略实验仪器的比热容及溶液体积的变化,则△H1=-56.9kJ/mol.(已知溶液密度均为1g/cm3)