题目内容
19.氮化铝(AIN,遇水易水解)广泛应用于集成电路生产领域.某研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计如图1所示实验装置.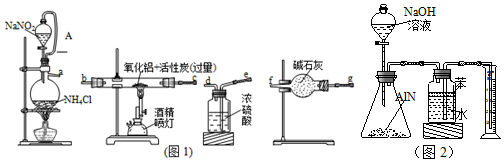
请回答:
(1)图1中用饱和NaNO2溶液与NH4Cl溶液加热制取氮气,该化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+2H2O+N2↑.
(2)图1装置中各仪器导管口连接的顺序是(用小写字母a→g填写):a-e-d-g-c(或b)c(或b)-g-f或a-e-d-g-f--b(或c)-c(或b)-g-f;导管A的作用是平衡分液漏斗与烧瓶之间的压强,使NaNO2饱和溶液顺利滴下.
(3)按(2)连接好实验装置后,接下来的操作是检查装置的气密性
(4)按(2)连接的实验装置存在的缺陷是洗气瓶没有防倒吸装置,没有尾气处理装置
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计).
①氮化铝与过量的NaOH溶液反应生成氨气化学反应方程式为AlN+NaOH+H2O═NaAlO2+NH3↑;
②集气瓶中的苯的作用是防止氨气溶于水;集气瓶中的液体没有装满,则实验测得NH3的体积将不变(填“偏大”、“偏小”、“不变”).
③若实验中称取氮化铝样品的质量为10.0g,测得氨气的体积3.36L(标准状况),则样品中AlN的质量分数为61.5%(保留3位有效数字).
分析 (1)饱和NaNO2溶液与NH4Cl反应生成氮气、氯化钠和水;
(2)用饱和NaNO2溶液与NH4Cl溶液加热制取氮气与氧化铝反应,因氮化铝易水解,故流程中应注意无水,则氮气从a经浓硫酸干燥,为干燥充分,导管长进短出,连接e、d,为干燥充分,可再连接一个干燥管,gf,在玻璃管中反应,故连接bc,为防止空气中的水蒸气进入装置,最后连接一个干燥管gf;导管A的作用是平衡分液漏斗与烧瓶之间的压强,使NaNO2 饱和溶液顺利滴下;
(3)有气体的实验装置要检查装置气密性;
(4)洗气瓶没有防倒吸装置,实验必须对有毒气体进行尾气处理,防止空气污染;
(5)氮化铝和氢氧化钠反应会生成氨气,AlN+NaOH+H2O═NaAlO2+NH3↑,氨气进入广口瓶后,如果装置密闭,广口瓶中压强会增大,那么就会有水通过广口瓶的长管进入量筒中,根据等量法可知,进入到广口瓶中水的体积就等于生成的氨气的体积.所以通过量筒中排出的水的体积就可以知道氨气的体积,进而根据方程式求出氮化铝的质量,据此分析解答.
解答 解:(1)图1中用饱和NaNO2溶液与NH4Cl溶液加热制取氮气,化学方程式为:NaNO2+NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ NaCl+2H2O+N2↑;
故答案为:NaNO2+NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ NaCl+2H2O+N2↑;
(2)用饱和NaNO2溶液与NH4Cl溶液加热制取氮气与氧化铝反应,因氮化铝易水解,故流程中应注意无水,则氮气从a经浓硫酸干燥,为干燥充分,导管长进短出,连接e、d,为干燥充分,可再连接一个干燥管,gf,在玻璃管中反应,故连接bc,为防止空气中的水蒸气进入装置,最后连接一个干燥管gf;导管A的作用是平衡分液漏斗与烧瓶之间的压强,使NaNO2 饱和溶液顺利滴下;
故答案为:a-e-d-g-c(或b)c(或b)-g-f或a-e-d-g-f--b(或c)-c(或b)-g-f;平衡分液漏斗与烧瓶之间的压强,使NaNO2 饱和溶液顺利滴下;
(3)有气体的实验装置要检查装置气密性;
故答案为:检查装置的气密性;
(4)洗气瓶没有防倒吸装置,实验必须对有毒气体进行尾气处理,防止空气污染;
故答案为:洗气瓶没有防倒吸装置,没有尾气处理装置;
(5)①氮化铝与过量的NaOH溶液反应生成氨气化学反应方程式为:AlN+NaOH+H2O═NaAlO2+NH3↑;
故答案为:AlN+NaOH+H2O═NaAlO2+NH3↑;
②因为氨气极易溶于水,所以广口瓶的水面上应加一层苯,来将气体和水隔绝,广口瓶中的气压之所以会增大,是因为有氨气进入,所以无论广口瓶中是否有空气,进入瓶中氨气的体积都等于排进量筒中水的体积,所以不受影响;
故答案为:防止氨气溶于水;不变;
③氨气的体积为3.36L(标准状况),则n(氨气)=3.36L÷22.4L/mol=0.15mol,所以氮化铝的物质的量是0.15mol,质量是0.15mol×41g/mol=6.15g,所以氮化铝的质量分数为(6.15÷10)×100%=61.5%;
故答案为:61.5%.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,解答本题要知道制取气体的一般步骤,知道用排水法测定气体体积的方法,由于氨气极易溶于水,要用植物油将氨气与水分开,综合性强,难度大.

 应用题作业本系列答案
应用题作业本系列答案| A. | CO2 | B. | NH3 | C. | SO3 | D. | H2S |
| A. | 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数为2 NA | |
| B. | 0.1 mol/L (NH4)2SO4溶液与0.2 mol/L NH4Cl溶液中的NH4+数目相同 | |
| C. | 标准状况下,H2和CO混合气体8.96 L在足量O2中充分燃烧消耗O2分子数为0.2 NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| A. | 分子式为C5H10O2且能与Na2CO3溶液反应产生气体的有机物的同分异构体有4种 | |
| B. | 用酸性高锰酸钾溶液既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯 | |
| C. | 乙烷和氯气制氯乙烷和乙烯与氯化氢反应制氯乙烷反应类型不同 | |
| D. | 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体 |
 电解尿素的碱性溶掖可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).下列有关说法中不正确的是( )
电解尿素的碱性溶掖可以制取氢气,其装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).下列有关说法中不正确的是( )| A. | 电解过穆中b极附近溶液碱性明显增强 | |
| B. | 溶液中的OH-逐渐向a极区附近移动 | |
| C. | 若在b极产生标准状况下224mL氢气,则消耗尿素2g | |
| D. | a极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O |
| A. | 简单氢化物的沸点:X<W | B. | 元素的非金属性:W<X | ||
| C. | Y、Z的氧化物均含有离子键 | D. | Y、W形成的化合物的水溶液显碱性 |
 电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH•H2O)]=l.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH•H2O)]=l.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定二甲胺溶液的曲线 | |
| B. | a点溶液中:c[(CH3)2NH2+]>c[(CH3)2NH•H2O] | |
| C. | d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH•H2O] | |
| D. | b、c、e三点的溶液中,水的电离程度最大的是b点 |
| A. | 将氯气通入氯化亚铁溶液:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO42-═BaSO4↓ | |
| D. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |