题目内容
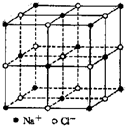 食盐晶体如图所示.在晶体中,?表示Na+,ο 表示Cl-.已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是( )
食盐晶体如图所示.在晶体中,?表示Na+,ο 表示Cl-.已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是( )A、
| |||||
B、
| |||||
C、
| |||||
D、
|
考点:晶胞的计算
专题:化学键与晶体结构
分析:在食盐晶体中Na+和Cl-的核间距为氯化钠晶胞边长的一半,根据密度和晶胞的质量可以求得晶胞的体积,进而求得晶胞边长,据此解题.
解答:
解:根据晶胞的结构图 可知,在氯化钠晶胞中含有氯离子数为1+12×
可知,在氯化钠晶胞中含有氯离子数为1+12×
=4,钠离子数为8×
+6×
=4,设晶胞边长为a,由ρ=
可得,ρ=
,所以a=
,所以Na+和Cl-的核间距=
a=
,故选项B正确,
故选B.
 可知,在氯化钠晶胞中含有氯离子数为1+12×
可知,在氯化钠晶胞中含有氯离子数为1+12×| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| 4M |
| a3N |
| 3 |
| ||
| 1 |
| 2 |
| 3 |
| ||
故选B.
点评:本题主要考查了晶胞密度的计算的应用,难度较小.

练习册系列答案
相关题目
下列关于碳酸钠和碳酸氢钠的比较中,正确的是( )
| A、二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度 |
| B、二者热稳定性不同,碳酸氢钠的热稳定性大于碳酸钠的热稳定性 |
| C、二者都能与盐酸反应放出二氧化碳气体,但碳酸钠生成的气体的速率更快 |
| D、等浓度时,碳酸钠溶液的PH大于碳酸氢钠溶液的PH |
下列有关胶体的说法正确的是( )
| A、胶体都是澄清透明的 |
| B、胶体与溶液的本质区别是有丁达尔效应 |
| C、将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 |
| D、胶体一定是混合物 |
下列依据相关实验得出的结论正确的是( )
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊.该溶液一定是碳酸盐溶液 |
| B、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 |
| C、将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2 |
| D、向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
为了检验某晶体中是否含有NH4+、SO42-、Fe2+和结晶水,设计了下列操作步骤:
①取少量该晶体于试管中,加热,发现试管口处有液体,且该液体能使无水硫酸铜变蓝;
②取少量该晶体的溶液于试管中,加入KSCN溶液,没有明显的变化,滴加几滴氯水,溶液显红色;
③取少量该晶体的溶液于试管中,再加入盐酸,没有明显的变化.再加入BaCl2溶液,有白色沉淀产生;
④取少量该晶体的溶液于试管中,加入浓NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时还有白色沉淀产生,该沉淀很快变成灰绿色沉淀最终变为红褐色沉淀.下列说法正确的是( )
①取少量该晶体于试管中,加热,发现试管口处有液体,且该液体能使无水硫酸铜变蓝;
②取少量该晶体的溶液于试管中,加入KSCN溶液,没有明显的变化,滴加几滴氯水,溶液显红色;
③取少量该晶体的溶液于试管中,再加入盐酸,没有明显的变化.再加入BaCl2溶液,有白色沉淀产生;
④取少量该晶体的溶液于试管中,加入浓NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时还有白色沉淀产生,该沉淀很快变成灰绿色沉淀最终变为红褐色沉淀.下列说法正确的是( )
| A、实验②中发生反应的离子方程式为:Fe2++Cl2=Fe3++2Cl-;Fe3++3SCN-=Fe(SCN)3 |
| B、只做实验①③④,也能达到实验目的 |
| C、通过上述实验可确定该化合物化学式为:(NH4)2Fe(SO4)2?6H2O,是一种浅绿色晶体,商品名为摩尔盐 |
| D、为了检验SO42-,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |
等体积、等物质的量浓度的Na2SO4和Na2CO3溶液中,阴阳离子总数相比( )
| A、前者多 | B、后者多 |
| C、一样多 | D、无法判断 |