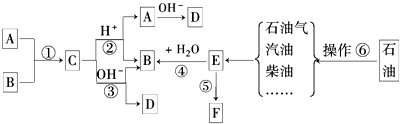
题目内容
某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧.他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
实验:将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.
提出假设:假设1:白色物质是Na2O,假设2:白色物质是Na2CO3.
假设3:
设计实验方案.验证假设:该小组对燃烧后的白色产物进行如下探究:
思考与交流:
(1)甲同学认为方案1得到的结论不正确,其理由是 .
(2)乙同学认为方案2得到的结论正确,白色物质为 .
(3)通过方案1和方案2的实验,你认为上述三个假设中, 成立.你的理由是 .
(4)钠在二氧化碳中燃烧的化学方程式为
(5)丙同学认为白色物质有可能是氢氧化钠.你是否同意丙同学的观点,并简述理由: .
实验:将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.
提出假设:假设1:白色物质是Na2O,假设2:白色物质是Na2CO3.
假设3:
设计实验方案.验证假设:该小组对燃烧后的白色产物进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
| ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
(1)甲同学认为方案1得到的结论不正确,其理由是
(2)乙同学认为方案2得到的结论正确,白色物质为
(3)通过方案1和方案2的实验,你认为上述三个假设中,
(4)钠在二氧化碳中燃烧的化学方程式为
(5)丙同学认为白色物质有可能是氢氧化钠.你是否同意丙同学的观点,并简述理由:
考点:性质实验方案的设计
专题:实验设计题
分析:钠在二氧化碳中燃烧生成的白色固体可能为Na2O、Na2CO3或Na2O和 Na2CO3混合物;
(1)碳酸钠溶液水解呈碱性,氧化钠溶于水反应生成氢氧化钠溶液呈碱性;
(2)加入过量氯化钡有白色沉淀证明含有碳酸钠,上层溶液酚酞不变色说明无碱生成判断一定无氧化钠;
(3)依据方案①②的反应现象和结论综合分析判断;假设2符合反应现象,溶于水溶液呈碱性,加入过量氯化钙沉淀后的溶液遇酚酞不变色证明不含氧化钠;
(4)依据方案①②的反应现象和结论,分析和推断钠在二氧化碳中燃烧生成碳酸钠和碳;
(5)依据反应物中的元素守恒分析判断生成物的组成元素.
(1)碳酸钠溶液水解呈碱性,氧化钠溶于水反应生成氢氧化钠溶液呈碱性;
(2)加入过量氯化钡有白色沉淀证明含有碳酸钠,上层溶液酚酞不变色说明无碱生成判断一定无氧化钠;
(3)依据方案①②的反应现象和结论综合分析判断;假设2符合反应现象,溶于水溶液呈碱性,加入过量氯化钙沉淀后的溶液遇酚酞不变色证明不含氧化钠;
(4)依据方案①②的反应现象和结论,分析和推断钠在二氧化碳中燃烧生成碳酸钠和碳;
(5)依据反应物中的元素守恒分析判断生成物的组成元素.
解答:
解:钠在二氧化碳中燃烧生成的白色固体可能为Na2O、Na2CO3或Na2O和 Na2CO3混合物,故答案为:白色物质是Na2O和 Na2CO3混合物;
(1)取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液溶液变红,原因有,可以是生成的氧化钠溶于水和水反应生成氢氧化钠溶液的作用,也可以碳酸钠溶液水解显碱性的作用,也可以是二者的混合物,所以方案1不正确,
故答案为:Na2CO3溶液显碱性,也会使酚酞变红;
(2)取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液,出现白色沉淀,说明含有碳酸钠,静置片刻,取上层清液于试管中,滴加无色酚酞试液无变化,说明一定无氧化钠,因为氧化钠和水反应一定生成氢氧化钠溶液,故答案为:Na2CO3;
(3)依据上述分析和现象判断,假设2正确;因为取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液,出现白色沉淀,说明含有碳酸钠,静置片刻,取上层清液于试管中,滴加无色酚酞试液无变化,说明一定无氧化钠,因为氧化钠和水反应一定生成氢氧化钠溶液,
故答案为:假设2;方案2①中出现的白色沉淀是CaCO3,所以燃烧后的白色产物中Na2CO3存在;方案2②中滴加无色酚酞试液无明显现象,说明燃烧后的白色产物中没有Na2O存在;
(4)依据现象和实验分析判断钠在二氧化碳气体中燃烧生成碳酸钠和碳单质,反应的化学方程式为:4Na+3CO2
2Na2CO3+C,
故答案为:4Na+3CO2
2Na2CO3+C;
(5)丙同学认为白色物质有可能是氢氧化钠.是错误的,在反应过程中,是钠在二氧化碳气体中 的燃烧反应,无氢元素的存在,实验依据元素守恒可置换不可能生成氢氧化钠,故答案为:不同意,因为反应物中无氢元素(或违背质量守恒定律).
(1)取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液溶液变红,原因有,可以是生成的氧化钠溶于水和水反应生成氢氧化钠溶液的作用,也可以碳酸钠溶液水解显碱性的作用,也可以是二者的混合物,所以方案1不正确,
故答案为:Na2CO3溶液显碱性,也会使酚酞变红;
(2)取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液,出现白色沉淀,说明含有碳酸钠,静置片刻,取上层清液于试管中,滴加无色酚酞试液无变化,说明一定无氧化钠,因为氧化钠和水反应一定生成氢氧化钠溶液,故答案为:Na2CO3;
(3)依据上述分析和现象判断,假设2正确;因为取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液,出现白色沉淀,说明含有碳酸钠,静置片刻,取上层清液于试管中,滴加无色酚酞试液无变化,说明一定无氧化钠,因为氧化钠和水反应一定生成氢氧化钠溶液,
故答案为:假设2;方案2①中出现的白色沉淀是CaCO3,所以燃烧后的白色产物中Na2CO3存在;方案2②中滴加无色酚酞试液无明显现象,说明燃烧后的白色产物中没有Na2O存在;
(4)依据现象和实验分析判断钠在二氧化碳气体中燃烧生成碳酸钠和碳单质,反应的化学方程式为:4Na+3CO2
| ||
故答案为:4Na+3CO2
| ||
(5)丙同学认为白色物质有可能是氢氧化钠.是错误的,在反应过程中,是钠在二氧化碳气体中 的燃烧反应,无氢元素的存在,实验依据元素守恒可置换不可能生成氢氧化钠,故答案为:不同意,因为反应物中无氢元素(或违背质量守恒定律).
点评:本题考查物质的组成探究,为高频考点,侧重于学生的分析能力和实验能力的考查,注重于物质性质的综合应用,反应现象的分析判断,反应产物的分析判断,实验现象是解题判断的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列化学事实及其结论都正确的是( )
| A、铝制饮具最好不要盛放酸性、或碱性较强的液体食物,因为Al和Al2O3既可以与酸反应、又可以与碱反应 |
| B、将SO2通入含HClO的溶液中,生成H2SO4,说明HClO酸性比H2SO4 强 |
| C、FeCl3溶液可以腐蚀线路板上的Cu,说明Fe的金属活动性大于Cu |
| D、过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解是因为铜可直接与1mol/L稀硫酸反应 |
将某溶液逐滴加入氢氧化铁溶胶内,开始时产生沉淀,继续滴加时沉淀溶解,该溶液是( )
| A、2mol/L H2SO4 溶液 |
| B、2mol/L NaOH溶液 |
| C、2mol/L MgSO4溶液 |
| D、硅酸溶胶 |
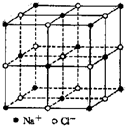 食盐晶体如图所示.在晶体中,?表示Na+,ο 表示Cl-.已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是( )
食盐晶体如图所示.在晶体中,?表示Na+,ο 表示Cl-.已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是( )A、
| |||||
B、
| |||||
C、
| |||||
D、
|
在一次化学实验操作考核中,某班同学有如下几种操作和应急措施,其中不正确的是( )
A、 酒精失火用湿抹布扑盖 |
B、 将NaCl倒入量筒中配制溶液 |
C、 研磨闻气味鉴别挥发性固体 |
D、 分离溶液中析出的KNO3晶体 |
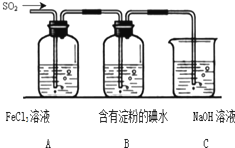 为探究SO2气体的还原性某兴趣小组设计了如图装置图:
为探究SO2气体的还原性某兴趣小组设计了如图装置图: