题目内容
3.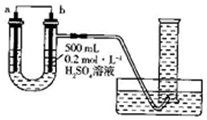 利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )
利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )| A. | a电极的电极材料是铜 | |
| B. | 如果将稀硫酸换为CuSO4溶液,则不能达到实验目的 | |
| C. | 锌与稀硫酸反应时放出的热量对实验测定不产生影响 | |
| D. | 若量筒中收集到a L H2,则电解质溶液中通过了$\frac{a}{11.2}$mol电子 |
分析 纯铜片和纯锌片、稀硫酸组成原电池,由图可知b电极处有氢气生成,则b为铜,为正极;a为锌,为负极;b上氢离子得电子生成氢气,电极反应式为:2H++2e-═H2↑,据此分析.
解答 解:A、由图可知b电极处有氢气生成,则b为铜,为正极;a为锌,为负极,故A错误;
B、如果将稀硫酸换为CuSO4溶液,则b上铜离子得电子生成铜,无气体生成,则不能达到实验目的,故B正确;
C、锌与稀硫酸反应时放出的热量会使气体温度升高膨胀,则对实验测定会产生影响,故C错误;
D、电解质溶液中无电子通过,故D错误;
故选B.
点评 本题考查了原电池的工作原理知识,主要考查正负极的判断、电极方程式的书写、电子守恒在计算中的应用等,注意知识的积累是解题关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
| A. | 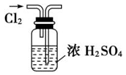 干燥Cl2 干燥Cl2 | B. |  吸收HCl | C. | 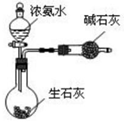 制备干燥的氨气 | D. | 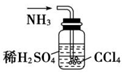 吸收NH3 |
14.下列电子式书写正确的是( )
| A. | 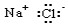 | B. |  | C. | 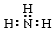 | D. |  |
11.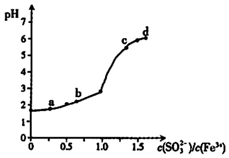 向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:
向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:
i.a点溶液透明澄清,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色:
ii.c点和d点溶液中产生红褐色沉淀,无气体逸出.取其上层清波滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色.
下列分析合理的是( )
 向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:
向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:i.a点溶液透明澄清,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色:
ii.c点和d点溶液中产生红褐色沉淀,无气体逸出.取其上层清波滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色.
下列分析合理的是( )
| A. | 向a点溶液中滴加BaCl2溶液,无明显现象 | |
| B. | b点较a点溶液pH升高的主要原因:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+ | |
| C. | c点溶液中发生的主要反应:2Fe3++3SO32-+6H2O?2Fe( OH)3+3H2SO3 | |
| D. | 向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深 |
18.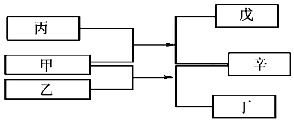 A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
 A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )| A. | 元素B、C、D的原子半径由大到小的顺序为 r(D)>r(C)>r(B) | |
| B. | 1L0.lmol/L戊溶液中阴离子的总物质的量小于0.1mol | |
| C. | 1mol甲与足量的乙完全反应共转移了约6.02×1023个电子 | |
| D. | 元素的非金属性B>C>A |
8.下列有关有机物结构和性质的描述正确的是( )
| A. | 甲苯、氯乙烯、苯乙炔分子内所有原子一定在同一平面上 | |
| B. | 苯、乙烯、聚乙烯都能发生加成反应,也能发生氧化反应 | |
| C. | 等质量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等 | |
| D. | 分子式为C5H10O2,能发生水解反应但不能发生银镜反应的有机物有5种 |
15.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,其中只有一种金属元素,X是周期表中原子半径最小的元素,Y的最高正价与最低负价绝对值相等,W最外层电子数是最内层电子数的3倍,R是同周期元素中原子半径最小的元素.下列说法不正确的是( )
| A. | 原子半径Z>W>R | |
| B. | 对应的氢化物的热稳定性:R>W>Y | |
| C. | 单质Z可与R的最高价含氧酸发生置换反应 | |
| D. | W与R所形成的简单离子均能影响水的电离平衡 |
12. 石墨烯锂-硫电池是一种高容量、长循环寿命、低成本及环境友好的新型二次电池,该电池结构如图所示,电池反应为2Li+nS$?_{充电}^{放电}$Li2Sn.有关该电池的说法正确的是( )
石墨烯锂-硫电池是一种高容量、长循环寿命、低成本及环境友好的新型二次电池,该电池结构如图所示,电池反应为2Li+nS$?_{充电}^{放电}$Li2Sn.有关该电池的说法正确的是( )
 石墨烯锂-硫电池是一种高容量、长循环寿命、低成本及环境友好的新型二次电池,该电池结构如图所示,电池反应为2Li+nS$?_{充电}^{放电}$Li2Sn.有关该电池的说法正确的是( )
石墨烯锂-硫电池是一种高容量、长循环寿命、低成本及环境友好的新型二次电池,该电池结构如图所示,电池反应为2Li+nS$?_{充电}^{放电}$Li2Sn.有关该电池的说法正确的是( )| A. | 放电时,Li+向负极迁移 | |
| B. | 充电时,A电极连接电源的负极 | |
| C. | 充电时,每生成n mol S转移2n mol电子 | |
| D. | 放电时,正极上可发生反应2Li++2Li2S6+2e-═3Li2S4 |
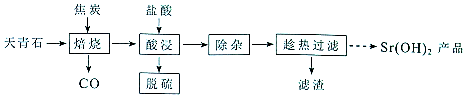
13.锶有“金属味精”之称.以天青石(主要含有SrSO4和少量CaCO3. MgO杂质)生产氢氧化锶的工艺如图:
已知氢氧化锶在水中的溶解度:
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑.
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12.
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=1.2×10-10.
②若pH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,导致氢氧化锶沉淀析出.
(3)“趁热过滤”的目的是防止温度降低氢氧化锶析出造成产品的损失,可使钙离子尽可能转化为Ca(OH)2.“滤渣”的主要成分为Mg(OH)2、Mg(OH)2.
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶或冷却结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCI3溶液吸收酸浸产生的气体,吸收时的氧化产物为S(填化学式):再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是FeCl3.

已知氢氧化锶在水中的溶解度:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12.
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=1.2×10-10.
②若pH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,导致氢氧化锶沉淀析出.
(3)“趁热过滤”的目的是防止温度降低氢氧化锶析出造成产品的损失,可使钙离子尽可能转化为Ca(OH)2.“滤渣”的主要成分为Mg(OH)2、Mg(OH)2.
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶或冷却结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCI3溶液吸收酸浸产生的气体,吸收时的氧化产物为S(填化学式):再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是FeCl3.