题目内容
18.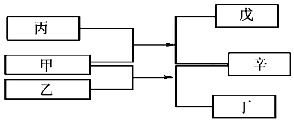 A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )| A. | 元素B、C、D的原子半径由大到小的顺序为 r(D)>r(C)>r(B) | |
| B. | 1L0.lmol/L戊溶液中阴离子的总物质的量小于0.1mol | |
| C. | 1mol甲与足量的乙完全反应共转移了约6.02×1023个电子 | |
| D. | 元素的非金属性B>C>A |
分析 0.1 mol/L 丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+辛,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,辛是由C组成的单质,由发生反应可知,辛不能是Na,结合原子数可知,A为H、C为O、D为Na元素,故辛为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+辛,可知丙是二氧化碳,戊是碳酸钠,则B为碳元素,结合对应单质、化合物的性质以及题目要求可解答该题.
解答 解:由以上分析可知A为H、B为C、C为O、D为Na元素,甲为Na2O2、乙是水、丙是二氧化碳,丁为NaOH、戊是碳酸钠,
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径大小顺序为:Na>C>O,即:D>B>C,故A错误;
B.戊是碳酸钠,在碳酸钠溶液中,CO32-离子水解生成HCO3-离子和OH-离子,溶液中阴离子总的物质的量大于0.1mol,故B错误;
C.甲与足量的乙完全反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,反应中过氧化钠其氧化剂、还原剂作用,各占一半,故1molNa2O2反应转移的电子为1mol×$\frac{1}{2}$×2=1mol,故C正确;
D.同周期元素从左到右元素的非金属性逐渐增强,则O>C,故D错误.
故选D.
点评 本题考查元素化合物推断,为高考常见题型,侧重考查学生的分析能力,题目难度中等,需要学生熟练掌握元素化合物知识,丁溶液pH值是推断突破口,对学生的逻辑推理有一定的要求,B选项注意盐类水解.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
8. A、B、C、D四种短周期元素在周期表中的位置如图所示,其中C的原子序数是D的原子序数的2倍.下列有关说法正确的是( )
A、B、C、D四种短周期元素在周期表中的位置如图所示,其中C的原子序数是D的原子序数的2倍.下列有关说法正确的是( )
 A、B、C、D四种短周期元素在周期表中的位置如图所示,其中C的原子序数是D的原子序数的2倍.下列有关说法正确的是( )
A、B、C、D四种短周期元素在周期表中的位置如图所示,其中C的原子序数是D的原子序数的2倍.下列有关说法正确的是( )| A. | B 的M层电子数是K层的3倍 | |
| B. | C 的离子具有与 Na+相同的电子层结构 | |
| C. | A 与 D 形成的化合物属于离子化合物 | |
| D. | C 的简单阴离子比 D 的简单阴离子还原性强 |
9.某同学设计了如下实验测量mg铜银合金样品中铜的质量分数:

下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 铜、银都能与硝酸反应,收集到的VL气体全为NO | |
| B. | 操作I、II、III分别为过滤、洗涤、干燥 | |
| C. | 利用气体体积VL及样品质量mg可计算铜的质量分数 | |
| D. | 久置的银器变黑、铜绿的形成都发生了氧化还原反应 |
13.下列实验中.对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验步骤 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 产生白色沉淀,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | 沉淀为BaSO3 |
| D | 向AgCl悬浊液中加入NaI溶液 | 出现黄色沉淀 | Ksp (AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
3. 利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )
利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )
 利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )
利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )| A. | a电极的电极材料是铜 | |
| B. | 如果将稀硫酸换为CuSO4溶液,则不能达到实验目的 | |
| C. | 锌与稀硫酸反应时放出的热量对实验测定不产生影响 | |
| D. | 若量筒中收集到a L H2,则电解质溶液中通过了$\frac{a}{11.2}$mol电子 |
10.化学与生产、生活、科技、环境等密切相关,下列说法正确的是( )
| A. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| B. | 铅笔芯的原材料为铅,所以儿童常咬铅笔头容易铅中毒 | |
| C. | 网络飞速发展,得益于光纤良好的导电性,光纤的主要成分是二氧化硅 | |
| D. | 用K2FeO4取代Cl2处理饮用水,不仅可杀菌消毒,同时还能沉降水中的悬浮物 |
7. X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )
X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )
 X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )
X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )| A. | 简单离子的半径:W>Z>R | |
| B. | XR与XRZ均为强酸 | |
| C. | 化合物W2Z2中既含离子键又含极性键 | |
| D. | 图中转化过程发生的反应均为化合反应 |
8.科学家研制出了一种新型的锂一空气电池,其工作原理如图所示.关于该电池的说法中不正确的是( )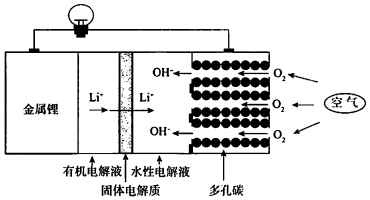

| A. | 回收水性电解液可制取锂 | |
| B. | 可将有机电解液改为水溶液 | |
| C. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| D. | 电池总反应方程式为4Li+O2+2H2O═4LiOH |
 某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.
某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.