题目内容
17.下列物质属于共价化合物的是( )| A. | MgO | B. | CO2 | C. | NH4Cl | D. | N2 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,只含共价键的化合物属于共价化合物,据此分析解答.
解答 解:A.MgO中Mg与O之间存在离子键,属于离子化合物,故A错误;
B.CO2分子中只存在共价键,属于共价化合物,故B正确;
C.NH4Cl中存在离子键和共价键,属于离子化合物,故C错误;
D.N2单质中只含共价键,但属于单质,不是化合物,故D错误;
故选B.
点评 本题考查单质、化合物、离子化合物、共价化合物等基本概念,侧重考查学生对概念的理解,注意这几个概念的区别,题目难度不大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
7.25℃时,水的电离达到平衡:H2O?H++OH-△H>0,下列叙述正确的是( )
| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| C. | 向水中加入少量固体NaOH,平衡逆向移动,c(H+)降低,KW减小 | |
| D. | 将水加热,KW增大,pH不变 |
8.下列各组物质能相互反应,最终能生成氢氧化铝的是( )
| A. | 铝和氢氧化钠溶液共热 | |
| B. | 氯化铝溶液中滴入过量氢氧化钾溶液 | |
| C. | 明矾溶液中滴入过量氨水 | |
| D. | 物质的量浓度相同的硝酸铝溶液和氢氧化钠溶液等体积混合 |
12. 2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”.
2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”.
为了提高公众认识地球保障发展的意识,全国各地广泛开展了一系列活动.下列活动中不符合这一宗旨的是( )
 2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”.
2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”.为了提高公众认识地球保障发展的意识,全国各地广泛开展了一系列活动.下列活动中不符合这一宗旨的是( )
| A. | 加强海底可燃冰的探测与开发研究 | |
| B. | 积极推广风能、水能和太阳能发电 | |
| C. | 在生产、流通、消费等领域中实行“减量化、再利用、资源化” | |
| D. | 将高能耗、高污染的企业迁至偏僻的农村地区,提高农民收入 |
2.下列各组微粒,半径大小比较中错误的是( )
| A. | K>Na>Li | B. | Na+>Mg2+>Al3+ | C. | Mg2+>Na+>F- | D. | S2->Cl->F- |
 氨既是实验室中常用试剂,也是工业上重要原料.
氨既是实验室中常用试剂,也是工业上重要原料.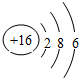 .
.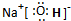 ,这种化合物形成的晶体中所含的化学键类型有离子键、共价键.
,这种化合物形成的晶体中所含的化学键类型有离子键、共价键.