题目内容
8.下列各组物质能相互反应,最终能生成氢氧化铝的是( )| A. | 铝和氢氧化钠溶液共热 | |
| B. | 氯化铝溶液中滴入过量氢氧化钾溶液 | |
| C. | 明矾溶液中滴入过量氨水 | |
| D. | 物质的量浓度相同的硝酸铝溶液和氢氧化钠溶液等体积混合 |
分析 A.Al与NaOH反应生成偏铝酸钠;
B.KOH过量时生成偏铝酸钾;
C.明矾中铝离子与氨水反应生成氢氧化铝沉淀;
D.物质的量浓度相同的硝酸铝溶液和氢氧化钠溶液等体积混合,碱不足.
解答 解:A.铝和氢氧化钠溶液共热,产生的是偏铝酸钠,故A不选;
B.由于NaOH过量,二者反应生成偏铝酸钾,故B不选;
C.明矾中铝离子与氨水反应生成氢氧化铝沉淀,生成沉淀,故C选;
D.物质的量浓度相同的硝酸铝溶液和氢氧化钠溶液等体积混合,碱不足,生成氢氧化铝沉淀,故D选;
故选CD.
点评 本题考查物质的性质及反应,为高频考点,把握发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意与量有关的离子反应,题目难度不大.

练习册系列答案
相关题目
18.某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O). 下列说法正确的是( )

| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从a 极区向b 极区迁移 | |
| C. | 每有44 g CO2被还原,则生成标准状况下 33.6 L O2 | |
| D. | a 电极的反应为:3CO2+16H+-18e-═C3H8O+4H2O |
19.下列反应的离子方程式书写正确的是( )
| A. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
16.25℃四种水溶液①HCl,②FeCl3,③KOH,④Na2CO3其 pH值依次为4、4、10、10,而溶液中水的电离程度大小关系正确的是( )
| A. | ①=②=③=④ | B. | ①=③>②=④ | C. | ④=②>③=① | D. | ①>③>②>④ |
3.在下列物质中,在一定条件下能与某些酸、碱、金属、非金属都反应的是…( )(双选,请举例说明.)
| A. | Al2O3 | B. | H2SO3 | C. | H2S | D. | NaHCO3 |
13. 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )| A. | 曲线①代表0.1mol/LKOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1mol/LKOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
17.下列物质属于共价化合物的是( )
| A. | MgO | B. | CO2 | C. | NH4Cl | D. | N2 |
18.下列对实验或生产的描述正确的是( )
| 选项 | 目的 | 试剂或试验方法 | 说明 |
| A | 从苯中提溴 | 加CCl4 | 溴易溶于CCl4 |
| B | 检验含Fe3+溶液中是否含Fe2+ | 加高锰酸钾溶液 | 溶液紫色褪去,说明含Fe2+ |
| C | 配置1mol/LFeCl3溶液100mL | 将一定质量FeCl3溶液转移至容量瓶中加水定容 | 容量瓶规格须为100mL |
| D | 制取漂白粉 | 将氯气通入澄清石灰水中 | 氯气与氢氧化钙反应生成次氯酸钙 |
| A. | A | B. | B | C. | C | D. | D |
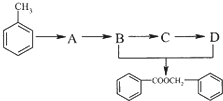
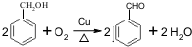 .
. 的化学方程式为
的化学方程式为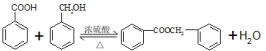 .
.