题目内容
5.现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况).(1)求消耗得锌的质量为多少克?
(2)如果选用所贴标签为2.0mol•L-1的盐酸,至少需该盐酸多少毫升?
(3)如果选用所贴标签为7%(密度为1.043g•mL-1)的盐酸,至少需该盐酸多少毫升?(Zn+2HCl=ZnCl2+H2)
分析 (1)根据转移电子守恒计算消耗Zn的质量;
(2)Zn和稀盐酸反应生成氢气,如果盐酸恰好完全反应时需要的盐酸体积最少,根据H原子守恒计算消耗n(HCl),再结合V=$\frac{n}{c}$计算盐酸体积;
(3)盐酸物质的量浓度=$\frac{1{0}^{3}ρω}{M}$,再结合V=$\frac{n}{c}$计算盐酸体积.
解答 解:(1)根据转移电子守恒得消耗m(Zn)=$\frac{\frac{4.48L}{22.4L/mol}×2}{2}×65g/mol$=13g,答:消耗锌的质量是13g;
(2)Zn和稀盐酸反应生成氢气,如果盐酸恰好完全反应时需要的盐酸体积最少,根据H原子守恒计算消耗n(HCl)=2n(H2)=2×$\frac{4.48L}{22.4L/mol}$=0.4mol,V=$\frac{n}{c}$=$\frac{0.4mol}{2.0mol/L}$=200mL,
答:至少需要该盐酸体积为200mL;
(3)盐酸物质的量浓度=$\frac{1{0}^{3}ρω}{M}$=$\frac{1000×1.043×7%}{36.5}$=2mol/L,V=$\frac{n}{c}$=$\frac{0.4mol}{2.0mol/L}$=200mL,
答:至少需要该盐酸体积为200mL.
点评 本题考查化学方程式的有关计算,为高频考点,明确各个物理量之间的关系式是解本题关键,注意守恒方法的应用,知道密度、质量分数与物质的量浓度的关系,为易错点.

练习册系列答案
相关题目
15.下列叙述错误的是( )
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用高锰酸钾酸性溶液可区分乙烷和乙烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用高锰酸钾酸性溶液可直接除去乙烷中的乙烯 |
16.25℃四种水溶液①HCl,②FeCl3,③KOH,④Na2CO3其 pH值依次为4、4、10、10,而溶液中水的电离程度大小关系正确的是( )
| A. | ①=②=③=④ | B. | ①=③>②=④ | C. | ④=②>③=① | D. | ①>③>②>④ |
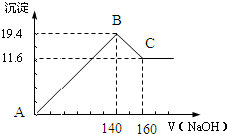
13. 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )| A. | 曲线①代表0.1mol/LKOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1mol/LKOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
10.下列微粒中:①13Al3+② ③F-,④
③F-,④ 其核外电子数相同的是( )
其核外电子数相同的是( )
 ③F-,④
③F-,④ 其核外电子数相同的是( )
其核外电子数相同的是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
17.下列物质属于共价化合物的是( )
| A. | MgO | B. | CO2 | C. | NH4Cl | D. | N2 |
14.下列离子方程式书写正确的是( )
| A. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 氧化钠与盐酸:O2-+2H+═H2O | |
| C. | 碳酸氢钠溶液与稀硫酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 烧碱溶液与碳酸氢钠溶液:HCO3-+OH-═H2O+CO2↑ |
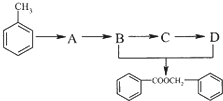
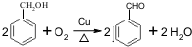 .
. 的化学方程式为
的化学方程式为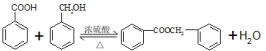 .
.