题目内容
2.下列各组微粒,半径大小比较中错误的是( )| A. | K>Na>Li | B. | Na+>Mg2+>Al3+ | C. | Mg2+>Na+>F- | D. | S2->Cl->F- |
分析 A.同主族自上而下原子半径增大;
B.核外电子排布相同,核电荷数越大离子半径越小;
C.核外电子排布相同,核电荷数越大离子半径越小;
D.最外层电子数相同,电子层越多离子半径越大,电子层数相等,质子数越多半径越小.
解答 解:A.同主族自上而下原子半径增大,故原子半径K>Na>Li,故A正确;
B.核外电子排布相同,核电荷数越大离子半径越小,故离子半径Na+>Mg2+>Al3+,故B正确;
C.核外电子排布相同,核电荷数越大离子半径越小,故离子半径F->Na+>Mg2+,故C错误;
D.最外层电子数相同,电子层越多离子半径越大,电子层数相等,质子数越多半径越小,故半径S2->Cl->F-,故D正确;
故选C.
点评 本题考查微粒半径大小比较,难度中等,关键清楚微粒半径大小比较的规律.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
12.下列关于SO2的说法中,不正确的是( )
| A. | SO2可使石蕊试液褪色 | B. | SO2有漂白和杀菌作用 | ||
| C. | SO2溶于水后生成H2SO4 | D. | SO2是一种大气污染物 |
13. 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )| A. | 曲线①代表0.1mol/LKOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1mol/LKOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
10.下列微粒中:①13Al3+② ③F-,④
③F-,④ 其核外电子数相同的是( )
其核外电子数相同的是( )
 ③F-,④
③F-,④ 其核外电子数相同的是( )
其核外电子数相同的是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
17.下列物质属于共价化合物的是( )
| A. | MgO | B. | CO2 | C. | NH4Cl | D. | N2 |
7.与17gNH3所含的原子数相等的CO是( )
| A. | 1mol CO | B. | 56 kgCO | ||
| C. | 1.204×1023个CO分子 | D. | 2 molCO |
14.下列离子方程式书写正确的是( )
| A. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 氧化钠与盐酸:O2-+2H+═H2O | |
| C. | 碳酸氢钠溶液与稀硫酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 烧碱溶液与碳酸氢钠溶液:HCO3-+OH-═H2O+CO2↑ |
11.下列反应的化学方程式书写正确的是( )
| A. | 实验室制取硝基苯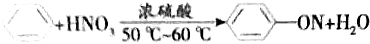 | |
| B. | 实验室制取溴苯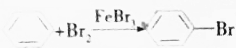 | |
| C. | 溴乙烷的消去反应 CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH2═CH2↑+NaBr+H2O | |
| D. | 制取TNT |
19.L、M、Q、R、T是短周期元素,如表是这些元素的原子半径及主要化合价信息:
请回答下列问题:
(1)上述元素中最活泼的金属元素是Mg(填元素符号,下同),最活泼的非金属元素是O.
(2)L、M、R、T的简单离子半径由大到小的顺序为S2->O2->Mg2+>Al3+(填离子符号).
(3)上述元素的最高价氧化物对应的水化物中碱性最强的是Mg(OH)2(填化学式,下同),具有两性的是Al(OH)3.
(4)上述元素形成的气态氢化物中最稳定的是H2O(填化学式).
(5)L、M的单质在稀硫酸中用导线连接可形成原电池,其正极材料是Mg.
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
(1)上述元素中最活泼的金属元素是Mg(填元素符号,下同),最活泼的非金属元素是O.
(2)L、M、R、T的简单离子半径由大到小的顺序为S2->O2->Mg2+>Al3+(填离子符号).
(3)上述元素的最高价氧化物对应的水化物中碱性最强的是Mg(OH)2(填化学式,下同),具有两性的是Al(OH)3.
(4)上述元素形成的气态氢化物中最稳定的是H2O(填化学式).
(5)L、M的单质在稀硫酸中用导线连接可形成原电池,其正极材料是Mg.