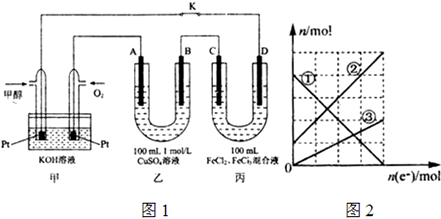
题目内容
下列离子方程式正确的是( )
| A、醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
| B、铁与盐酸反应:2Fe+6H+→2Fe3++3H2↑ |
| C、氯化铁溶液和氨水反应:Fe3++3OH-→Fe(OH)3↓ |
| D、氯化铝溶液中滴入过量氢氧化钠溶液:Al3++3OH-→Al(OH)3↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.反应生成醋酸钠和水;
B.反应生成氯化亚铁和氢气;
C.一水合氨在离子反应中保留化学式;
D.反应生成偏铝酸钠和水.
B.反应生成氯化亚铁和氢气;
C.一水合氨在离子反应中保留化学式;
D.反应生成偏铝酸钠和水.
解答:
解:A.醋酸与氢氧化钠溶液反应的离子反应为CH3COOH+OH-=CH3COO-+H2O,故A正确;
B.铁与盐酸反应的离子反应为Fe+2H+=Fe2++H2↑,故B错误;
C.氯化铁溶液和氨水反应的离子反应为Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+,故C错误;
D.氯化铝溶液中滴入过量氢氧化钠溶液的离子反应为Al3++4OH-=AlO2-+2H2O,故D错误;
故选A.
B.铁与盐酸反应的离子反应为Fe+2H+=Fe2++H2↑,故B错误;
C.氯化铁溶液和氨水反应的离子反应为Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+,故C错误;
D.氯化铝溶液中滴入过量氢氧化钠溶液的离子反应为Al3++4OH-=AlO2-+2H2O,故D错误;
故选A.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、与量有关的离子反应考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液.相同条件下,有关上述溶液的比较中,错误的是( )
| A、将②、③溶液混合后,pH=7,消耗溶液的体积:②>③ |
| B、①④等体积混合后,溶液显碱性 |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量①最大 |
| D、向溶液中加入100mL水后,溶液的pH:③>④>②>① |
化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
A、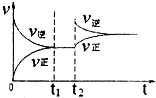 |
B、 |
C、 |
D、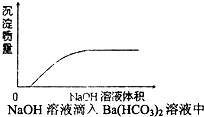 |
下列有关化学反应速率的说法正确的是( )
| A、用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
| B、100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速度减小 |
| C、SO2的催化氧化是一个放热的反应,所以升高温度,V逆加快,V正减慢 |
| D、对于CaCO3+2HCl═CaCl2+H2O+CO2↑不能用CaCO3的浓度变化来表示反应速率,但可用水的浓度变化来表示 |
将10.416克纯铁丝溶于过量的盐酸中,在加热条件下,用5.05克的KNO3去氧化溶液中的Fe2+,待反应完全后,剩余Fe2+还需要24ml0.3mol/L的KMnO4溶液才能完全氧化成Fe3+,此时MnO4-转化为Mn2+,则KNO3的还原产物为( )
| A、NO2 |
| B、NO |
| C、N2O |
| D、N2O5 |
下列反应中符合如图能量变化的是( )


| A、碳与二氧化碳化合成为一氧化碳 |
| B、HCl分解为H2和Cl2 |
| C、Na与H2O反应 |
| D、Ba(OH)2?8H2O和NH4Cl晶体混合反应 |
在2010年上海世博会上,清洁能源、低碳经济、节能减排等理念得到了充分体现.下列做法中不能体现上述理念的是( )
| A、某些馆的外壳使用非晶硅薄膜,以充分利用太阳能 |
| B、快餐盒用生物质材料“玉米塑料”(主要成分为可降解聚乳酸)做成 |
| C、使用的卫生纸都是再生纸 |
| D、把世博会期间产生的垃圾焚烧或深埋处理 |