题目内容
在铝-铜-浓硝酸原电池中,当导线中有1mol电子通时,理论上的两极变化是( )
①铝片溶解9g ②铜片溶解32g ③铜片上析出1gH2 ④铝片上析出1mol NO2.
①铝片溶解9g ②铜片溶解32g ③铜片上析出1gH2 ④铝片上析出1mol NO2.
| A、①③ | B、①④ | C、②③ | D、②④ |
考点:原电池和电解池的工作原理
专题:
分析:在铝-铜-浓硝酸原电池中,Cu易失电子作负极,电极反应为Cu-2e-=Cu2+,Al发生钝化,Al作正极,正极上硝酸根离子得电子生成二氧化氮,再根据Cu、NO2和转移电子之间的关系式计算.
解答:
解:在铝-铜-浓硝酸原电池中,Cu易失电子作负极,电极反应为Cu-2e-=Cu2+,Al发生钝化,Al作正极,正极上硝酸根离子得电子生成二氧化氮,
①铝片在浓硝酸中钝化,铝片不溶解,故错误;
②当导线中有1mol电子通时,电极反应为Cu-2e-=Cu2+,铜片反应了0.5mol,则铜片溶解32g,故正确;
③在铝-铜-浓硝酸原电池中,Cu易失电子作负极,所以铜片上没有析出H2,故错误;
④铝片上的电极反应为:2NO3-+2e-+2H+=2NO2↑+H2O,当导线中有1mol电子通时,析出1mol NO2,故正确;
故选D.
①铝片在浓硝酸中钝化,铝片不溶解,故错误;
②当导线中有1mol电子通时,电极反应为Cu-2e-=Cu2+,铜片反应了0.5mol,则铜片溶解32g,故正确;
③在铝-铜-浓硝酸原电池中,Cu易失电子作负极,所以铜片上没有析出H2,故错误;
④铝片上的电极反应为:2NO3-+2e-+2H+=2NO2↑+H2O,当导线中有1mol电子通时,析出1mol NO2,故正确;
故选D.
点评:本题考查了原电池原理,根据失电子难易程度确定正负极,知道正负极上发生的反应,注意电子守恒在计算中的应用,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒(如SARS病毒)、细菌、真菌及芽孢.过氧乙酸可由冰醋酸与过氧化氢在一定条件下作用制得,下列有关过氧乙酸的叙述中正确的是( )
| A、过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体 |
| B、过氧乙酸与苯酚混合使用,可增强过氧乙酸杀菌效果 |
C、由下列过氧乙酸的制取原理可以看出,过氧乙酸是酯的同系物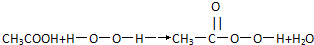 |
| D、浓过氧乙酸溶液中加入少许紫色石蕊试液,振荡后先变红,后褪色 |
化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
A、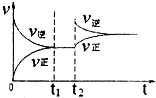 |
B、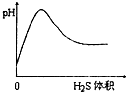 |
C、 |
D、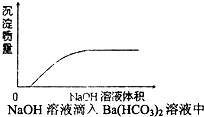 |
将10.416克纯铁丝溶于过量的盐酸中,在加热条件下,用5.05克的KNO3去氧化溶液中的Fe2+,待反应完全后,剩余Fe2+还需要24ml0.3mol/L的KMnO4溶液才能完全氧化成Fe3+,此时MnO4-转化为Mn2+,则KNO3的还原产物为( )
| A、NO2 |
| B、NO |
| C、N2O |
| D、N2O5 |
贴有下列危险品标志的药品起火时,不能用水灭火的是( )
A、 |
B、 |
C、 |
D、 |
下列反应中符合如图能量变化的是( )


| A、碳与二氧化碳化合成为一氧化碳 |
| B、HCl分解为H2和Cl2 |
| C、Na与H2O反应 |
| D、Ba(OH)2?8H2O和NH4Cl晶体混合反应 |
下列说法或表示方法正确的是( )
| A、催化剂能降低正反应的活化能,但不能改变逆反应的活化能 |
| B、在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C、由C(石墨)→C(金刚石);△H=+73 kJ/mol,可知金刚石比石墨稳定 |
| D、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
元素的性质与原子结构及周期表中的位置有着密切的关系.下列说法正确的是( )
| A、13C与14C互为同位素,化学性质相同,但相对原子质量一定不同 |
| B、某元素原子次外层电子数是最外层电子数的2倍,则该元素氧化物为酸性氧化物 |
| C、IA族元素与VIIA元素形成的化合物都为离子化合物 |
| D、短周期中,同周期元素的离子半径从左到右逐渐减少 |
用NA表示阿伏伽德罗常数.下列说法正确的是( )
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA |
| C、16.9gBaO2固体中阴、阳离子总数为0.2NA. |
| D、常温常压下,28g氮气含有的核外电子数为10 NA |