题目内容
7.将3.48g 四氧化三铁在 50mL 4mol/L的稀HNO3中充分反应,产生112mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀.当沉淀量最多时,至少需要加入2mol/L的NaOH溶液97.5mL (精确到0.1).分析 向反应后的溶液中滴加NaOH溶液能产生沉淀,当沉淀量最多时,恰好反应时消耗氢氧化钠溶液体积最小,此时溶液中溶质为NaNO3,由原子守恒可知n(NaOH)=n(NaNO3)=n(HNO3)-n(NO),再根据V=$\frac{n}{c}$计算需要氢氧化钠溶液的体积;
解答 解:向反应后的溶液中滴加NaOH溶液能产生沉淀,当沉淀量最多时,恰好反应时消耗氢氧化钠溶液体积最小,此时溶液中溶质为NaNO3,
硝酸的物质的量为0.05L×4mol/L=0.2mol,生成NO的物质的量为$\frac{0.112L}{22.4L/mol}$=0.005mol
由原子守恒可知n(NaOH)=n(NaNO3)=n(HNO3)-n(NO)=0.2mol-0.005mol=0.195mol,
需要氢氧化钠溶液的体积为$\frac{0.195mol}{2mol/L}$=0.0975L,即为97.5mL,
故答案为:97.5.
点评 本题考查化学方程式计算,侧重考查学生分析计算能力,注意利用守恒法计算解答.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
2.标准状况下,现有①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,对这四种气体的关系有以下四种表述:
a.体积:②>③>①>④
b.物质的量:②>③>④>①
c.质量:②>③>①>④
d.氢原子个数:①>③>④>②
其中正确的是( )
a.体积:②>③>①>④
b.物质的量:②>③>④>①
c.质量:②>③>①>④
d.氢原子个数:①>③>④>②
其中正确的是( )
| A. | abc | B. | bcd | C. | abcd | D. | acd |
19.金属钠分别与下列物质的溶液反应时,既有气体放出又有白色沉淀生成的是( )
| A. | 盐酸 | B. | 氯化钠 | C. | 氯化铜 | D. | 氯化镁 |
16.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 炭具有强还原性,高温下能将二氧化硅还原为硅 | |
| B. | Na的金属性比Mg强,可用Na与MgCl2溶液反应制取金属Mg | |
| C. | 光照时乙烷和氯气能发生取代反应,工业上常用该反应生产氯乙烷 | |
| D. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 |
17.化学与社会、生活紧密相关.下列说法不正确的是( )
| A. | 化学危险品发生爆炸事故后,人员应该向上风方向撤离 | |
| B. | 含有硫酸的工业废水用硝酸钡处理后再排放有利于减少水体污染 | |
| C. | 用聚苯乙烯代替聚乙烯作食品包装袋,可节约成本,但是不利于人体健康和环保 | |
| D. | “阅兵蓝”的出现说明京津冀实施道路限行和污染企业停工等措施,可以有效地减轻雾霾和保证空气质量 |
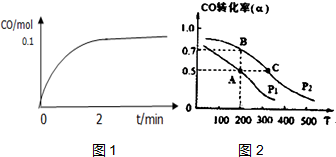 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO (g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO (g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol