题目内容
12.分析下列氧化还原反应,并完成下列填空.2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3
(1)用双线桥法表示氧化还原反应;
(2)被还原的元素是Fe,氧化产物Al2O3.
(3)氧化剂和还原剂物质的量的比1:2.
分析 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3中,Fe元素的化合价降低,Al元素的化合价升高,结合氧化还原反应基本概念及电子守恒来解答.
解答 解:(1)反应2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe中,化合价降低元素Fe所在的反应物Fe2O3是氧化剂,化合价升高元素Al所在的反应物是还原剂,化合价的升降数=转移电子数=6,所以反应中生成2mol Fe时,转移6mol电子,反应中生成1mol Fe时,转移3mol电子,电子转移情况如下: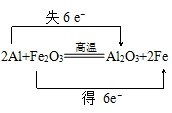 ,
,
故答案为: ;
;
(2)反应中Fe元素化合价降低,被还原,Al元素化合价升高,被氧化,Al2O3为氧化产物,
故答案为:Fe;Al2O3;
(3)由方程式可知2molAl参加反应,消耗1molFe2O3,可知氧化剂和还原剂物质的量的比1:2,
故答案为:1:2.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.

练习册系列答案
相关题目
5.为了除去氯化镁酸性溶液中的铁离子,可在加热的条件下加入一种试剂,再向滤液中加入适量的盐酸,这种试剂是( )
| A. | NH3•H2O | B. | Mg(OH)2 | C. | Na2CO3 | D. | MgCO3 |
3.下列事实与胶体性质无关的是( )
| A. | 自来水厂用含铁的化合物作净水剂 | |
| B. | 用丁达尔效应区分氢氧化铁胶体和氯化铁溶液 | |
| C. | 一束平行光照射蛋白质溶液时,从侧面要看到光亮的通路 | |
| D. | 在三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
20.物质的量均为0.1mol的A1C13、CuC12和H2SO4溶于水制成100mL的混合溶液,用石墨作电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同,则下列描述正确的是( )
| A. | 电路中共转移0.7mol电子 | |
| B. | 阴极得到的气体物质的量为0.35mol | |
| C. | 阴极质量增加3.2g | |
| D. | 铝元素以A1(OH)3的形式存在 |
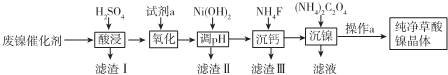
17.已知草酸镍晶体(NiC2O4•2H2O)难溶于水,工业上从废镍催化剂(成分主 要是Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的pH如表:
②Ksp(CaF2)=1.46×10-10
③当某物质模拟高度小于1.0×10-5mol.L-1时,视为完全沉淀.
(1)请写出一种能提高酸浸速率的措施把废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等.
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)pH的调控范围为5.0~6.8,试用化学反应原理的相关知识解释滤渣Ⅱ的生成.5.6~6.8
(4)写出“沉镍”时反应的离子方程式Ni2++C2O42-+2H2O=NiC2O4•2H2O,证明Ni2+已经沉淀完全的实验步骤及现象是取上层清液,继续滴加(NH4)2C2O4溶液,无沉淀生成,
(5)操作a的内容为过滤、洗涤、干燥.

已知:①相关金属离子生成氢氧化物沉淀的pH如表:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
③当某物质模拟高度小于1.0×10-5mol.L-1时,视为完全沉淀.
(1)请写出一种能提高酸浸速率的措施把废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等.
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)pH的调控范围为5.0~6.8,试用化学反应原理的相关知识解释滤渣Ⅱ的生成.5.6~6.8
(4)写出“沉镍”时反应的离子方程式Ni2++C2O42-+2H2O=NiC2O4•2H2O,证明Ni2+已经沉淀完全的实验步骤及现象是取上层清液,继续滴加(NH4)2C2O4溶液,无沉淀生成,
(5)操作a的内容为过滤、洗涤、干燥.
4.同温同压下,等质量的CO和CO2气体相比较,下列叙述中正确的是( )
| A. | 所含碳原子数比为1:1 | B. | 体积比为1:1 | ||
| C. | 密度比为7:11 | D. | 分子数比为7:11 |
2. T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.
(1)TY2是一种常用的溶剂,是非极性分子(填极性分子或非极性分子),分子中存在2个σ 键.W的最简单氢化物容易液化,理由是氟化氢分子之间存在着氢键.
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
(3)基态Y原子中,电子占据的最高能层符号M,该能层具有的原子轨道数为9、电子数为6.Y、氧、W元素的第一电离能由大到小顺序为F>O>S(用元素符号作答).
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00g/cm3,则晶胞边长为3.61×10-8cm;ZYO4常作电镀液,其中YO42-的空间构型是正四面体,其中Y原子的杂化轨道类型是sp3杂.元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示正确的是AD
A.O2是氧化剂B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1mol Z参加反应有1mol电子发生转移.
 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 Ni |
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
(3)基态Y原子中,电子占据的最高能层符号M,该能层具有的原子轨道数为9、电子数为6.Y、氧、W元素的第一电离能由大到小顺序为F>O>S(用元素符号作答).
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00g/cm3,则晶胞边长为3.61×10-8cm;ZYO4常作电镀液,其中YO42-的空间构型是正四面体,其中Y原子的杂化轨道类型是sp3杂.元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示正确的是AD
A.O2是氧化剂B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1mol Z参加反应有1mol电子发生转移.
 根据图填空:
根据图填空: