题目内容
1.(1)Al2(SO4)3的水溶液呈酸(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示)Al3++3H2O?Al(OH)3+3H+.(2)25℃下,pH=5的盐酸溶液中由水电离出的氢离子浓度为10-9mol/L;
25℃下,pH=5的氯化铵溶液中由水电离出的氢离子浓度为10-5mol/L.
(3)写出醋酸钠溶液中各离子浓度由大到小的关系c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
分析 (1)硫酸铝是强酸弱碱盐,铝离子水解导致溶液呈酸性;
(2)在酸溶液中,氢离子几乎全部来自于酸的电离,而氢氧根全部来自于水的电离;
在盐溶液中,氢离子和氢氧根均全部来自于水的电离;
(3)醋酸根离子水解,溶液显碱性.
解答 解:(1)硫酸铝是强酸弱碱盐,铝离子水解导致溶液呈酸性,水解方程式为Al3++3H2O?Al(OH)3+3H+,故答案为:酸;Al3++3H2O?Al(OH)3+3H+;
(2)25℃下,pH=5的盐酸溶液中c(H+)=10-5mol/L,c(OH-)=10-9mol/L,而在酸溶液中,氢离子几乎全部来自于酸的电离,而氢氧根全部来自于水的电离,故由水电离出的c(H+)=c(OH-)=10-9mol/L;
25℃下,pH=5的氯化铵溶液中,c(H+)=10-5mol/L,c(OH-)=10-9mol/L,但在氯化铵溶液中,氢离子和氢氧根均全部来自于水的电离,但由于铵根离子水解将部分氢氧根结合,故溶液中的氢离子是水电离出的全部,故由水电离出的c(H+)=c(OH-)=10-5mol/L;
故答案为:10-9mol/L;10-5mol/L;
(3)醋酸根离子水解,溶液显碱性,显性离子大于隐性离子,则离子关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
点评 本题考查酸碱溶液的混合、涉及电离、水解等,注重高考常考考点的考查,侧重反应原理的训练,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列物质中,可用作净水剂的是( )
| A. | 纯碱 | B. | 明矾 | C. | 蔗糖 | D. | 火碱 |
12.日常生活中的下列物质,属于人工合成材料的是( )
| A. | 羊毛 | B. | 棉线 | C. | 涤纶 | D. | 真丝巾 |
16.可用于区别溴蒸气与二氧化氮气体的试剂是( )
①淀粉碘化钾溶液②水③AgNO3溶液④NaOH溶液.
①淀粉碘化钾溶液②水③AgNO3溶液④NaOH溶液.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③④ |
3.下列事实与胶体性质无关的是( )
| A. | 自来水厂用含铁的化合物作净水剂 | |
| B. | 用丁达尔效应区分氢氧化铁胶体和氯化铁溶液 | |
| C. | 一束平行光照射蛋白质溶液时,从侧面要看到光亮的通路 | |
| D. | 在三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
10.下列关于化学用语的表示正确的是( )
| A. | 质子数为17、中子数为20的氯(Cl)原子:${\;}_{17}^{20}$Cl | |
| B. | CO2电子式: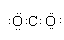 | |
| C. | 镁离子的结构示意图: | |
| D. | CCl4分子的比例模型: |