题目内容
2.标准状况下,现有①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,对这四种气体的关系有以下四种表述:a.体积:②>③>①>④
b.物质的量:②>③>④>①
c.质量:②>③>①>④
d.氢原子个数:①>③>④>②
其中正确的是( )
| A. | abc | B. | bcd | C. | abcd | D. | acd |
分析 a.相同条件下,气体体积之比等于物质的量之比;
b.根据n=$\frac{V}{{V}_{m}}$计算6.72LCH4的物质的量,根据n=$\frac{N}{{N}_{A}}$计算HCl的物质的量,根据n=$\frac{m}{M}$计算13.6gH2S的物质的量;
c.根据m=nM计算甲烷、HCl、氨气的质量;
d.根据各分子含有的H原子数目,计算各物质含有的H原子物质的量,
解答 解:①6.72L CH4的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,②3.01×1023 个HCl分子的物质的量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol,③13.6g H2S的物质的量为$\frac{13.6g}{34g/mol}$=0.4mol,④0.2mol NH3.
a.根据V=nVm知,相同条件下,气体体积之比等于物质的量之比,故体积:②>③>①>④,故a正确;
b.由上述计算可知,物质的量为:②>③>①>④,故b错误;
c.甲烷质量为0.3mol×16g/mol=4.8g,HCl的质量为0.5mol×36.5g/mol=33.25g,氨气的质量为0.2mol×17g/mol=3.4g,故质量:②>③>①>④,故c正确;
d.甲烷中n(H)=0.3mol×4=1.2mol,HCl中n(H)=0.5mol,硫化氢中n(H)=0.4mol×2=0.8mol,氨气中n(H)=0.2mol×3=0.6mol,故H原子数目:①>③>④>②,故c正确;
故选:D.
点评 本题考查物质的量的计算,掌握体积、物质的量、质量、微粒数目的关系及相关计算公式为解答本题的关键,题目难度不大.

练习册系列答案
相关题目
15.相同温度下,pH=3的盐酸和pH=3的醋酸溶液,由水电离产生的c(H+)( )
| A. | 前者小于后者 | B. | 前者大于后者 | C. | 前者等于后者 | D. | 不能确定 |
16.可用于区别溴蒸气与二氧化氮气体的试剂是( )
①淀粉碘化钾溶液②水③AgNO3溶液④NaOH溶液.
①淀粉碘化钾溶液②水③AgNO3溶液④NaOH溶液.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③④ |
10.下列关于化学用语的表示正确的是( )
| A. | 质子数为17、中子数为20的氯(Cl)原子:${\;}_{17}^{20}$Cl | |
| B. | CO2电子式: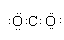 | |
| C. | 镁离子的结构示意图: | |
| D. | CCl4分子的比例模型: |
17.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加人过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 向1molFeBr2溶液中通入 1.5molCl2 :2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 氯化亚铁溶液中通人氯气:Fe2++Cl2═Fe3++2C1- |
14.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,8 g O2含有5NA个电子 | |
| B. | 1 L 1.0 mol•L-1NaAlO2溶液中含有氧原子数为2NA | |
| C. | 标准状况下,2.24 L CCl4中含有的分子数为0.1NA | |
| D. | 精炼铜的过程中,当阴极析出32 g铜时转移的电子数为NA |
11.下列物质按电解质、非电解质、混合物排序正确的是( )
| A. | 五水硫酸铜、SO2、空气 | B. | NH3、Cu、空气 | ||
| C. | 盐酸、硫酸、胶体 | D. | 氨水、食盐、酒精 |
12.X、Y、Z、W是短周期的四种元素,有关他们的信息如下表所示.
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)Z元素在周期表中的位置是第三周期第ⅦA族;Y的一种氧化物能导致温室效应,该氧化物的电子式火 ;Z的单质与W的单质一定条件下可发生反应生成化合物A,A中所含化学键类型为共价键.
;Z的单质与W的单质一定条件下可发生反应生成化合物A,A中所含化学键类型为共价键.
(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是HClO4>HNO3>H2CO3.
(3)实验室制取Z单质的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)实验室制取X的氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;工业上用此氢化物制取X的最高价含氧酸的第一步反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(5)实验室用X的氢化物的水溶液制取W的氢氧化物的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)Z元素在周期表中的位置是第三周期第ⅦA族;Y的一种氧化物能导致温室效应,该氧化物的电子式火
 ;Z的单质与W的单质一定条件下可发生反应生成化合物A,A中所含化学键类型为共价键.
;Z的单质与W的单质一定条件下可发生反应生成化合物A,A中所含化学键类型为共价键.(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是HClO4>HNO3>H2CO3.
(3)实验室制取Z单质的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)实验室制取X的氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;工业上用此氢化物制取X的最高价含氧酸的第一步反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(5)实验室用X的氢化物的水溶液制取W的氢氧化物的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.