题目内容
20. 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO (g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO (g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol(1)该反应的化学平衡常数K表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;温度升高,平衡常数K减小(填“增大”、“减小”或“不变”).
(2)下列措施中有利于增大该反应的反应速率且提高转化率的是d(填字母序号).
a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.使用高效催化剂
d.增大体系压强
(3)一定条件下,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇,平衡后将容器的容积压缩到原来的$\frac{1}{2}$,其他条件不变,对平衡体系产生的影响是cd(填字母序号).
a.c ( H2 )减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
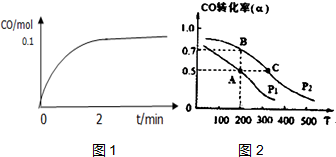
(4)一定温度下,向1L密闭容器中加入1molCH3OH(g)使其分解,测得气体CO的物质的量随时间的变化如图1所示.则0~2min内的平均反应速率v(H2)=0.1mol/(L.min).
(5)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P)的关系如图2所示.
①若A、C两点分别表示达到的平衡状态.则自反应开始达到平衡状态所需要的时间tA大于tC(填“大于”、“小于”或“等于”)
②若A点时容器的体积为1L,该温度下A点的平衡常数K=1 L2•mol-2.
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
(2)升高温度、增大物质浓度、增大压强、使用催化剂等可以加快反应速率,要提高转化率,应使平衡正向移动;
(3)a.体积压缩,平衡时各组分的浓度均增大;
b.体积压缩,压强增大,正逆反应速率都增大;
c.体积压缩,压强增大,平衡正向移动;
d.体积压缩,压强增大,平衡正向移动,氢气物质的量减小,甲醇物质的量增大;
(4)2min到达平衡,生成CO为0.1mol,根据方程式可知生成氢气为0.2mol,再根据v=$\frac{△c}{△t}$计算v(H2);
(5)①温度越高,反应速率越快,到达平衡时间越短;
②A点时容器的体积为1L,CO转化率为0.5,消耗CO为0.5mol,则:
CO (g)+2H2 (g)?CH3OH (g)
起始浓度(mol/L):1 2 0
变化浓度(mol/L):0.5 1 0.5
平衡浓度(mol/L):0.5 1 0.5
再根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数.
解答 解:(1)CO (g)+2H2 (g)?CH3OH (g)的化学平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$,
正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
故答案为:K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;减小;
(2)a.随时将CH3OH与反应混合物分离,平衡正向移动,转化率增大,但反应速率减慢,故a错误;
b.降低反应温度,平衡正向移动,转化率增大,但反应速率减慢,故b错误;
c.使用高效催化剂,加快反应速率,但不影响平衡移动,转化率不变,故c错误;
d.增大体系压强,反应速率加快,正反应为气体体积减小的反应,平衡正向移动,转化率增大,故d正确,
故选:d;
(3)a.体积压缩,压强增大,平衡正向移动,平衡常数不变,则平衡时各组分的浓度均增大,故a错误;
b.体积压缩,压强增大,正逆反应速率都增大,平衡正向移动,正反应速率增大更多,故b错误;
c.体积压缩,压强增大,平衡正向移动,CH3OH 的物质的量增加,故c正确;
d.体积压缩,压强增大,平衡正向移动,氢气物质的量减小,甲醇物质的量增大,重新平衡$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
,故d正确,
故选:cd;
(4)2min到达平衡,生成CO为0.1mol,根据方程式可知生成氢气为0.2mol,则v(H2)=$\frac{\frac{0.2mol}{1L}}{2min}$=0.1mol/(L.min),
故答案为:0.1mol/(L.min);
(5)①温度A<C,温度越高,反应速率越快,到达平衡时间越短,到平衡状态所需要的时间tA>tC,
故答案为:大于;
②A点时容器的体积为1L,CO转化率为0.5,消耗CO为0.5mol,则:
CO (g)+2H2 (g)?CH3OH (g)
起始浓度(mol/L):1 2 0
变化浓度(mol/L):0.5 1 0.5
平衡浓度(mol/L):0.5 1 0.5
故平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.5mol/L}{0.5mol/L×(1mol/L)^{2}}$=1 L2•mol-2,
故答案为:1 L2•mol-2.
点评 本题考查化学平衡计算与影响因素、平衡常数、化学反应速率计算及影响因素、化学平衡图象等,理解掌握平衡移动原理.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案(1)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
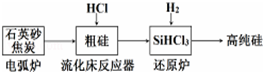
| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\frac{\underline{\;1600-1800℃\;}}{\;}$si+2CO |
| 流化床反应器 | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| 还原炉 |
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏.
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/°C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取.粉末状Si3N4遇空气和水都不稳定,但将粉末状的Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中进行热处理,可以制得结构十分紧密、对空气和水都相当稳定的固体材料,同时还得到遇水不稳定的Mg3N2.
①由SiCl4和NH3反应制取Si3N4的化学方程式为3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.
②四氯化硅和氮气在氢气气氛保护下,加强热发生反应,使生成的Si3N4沉积在石墨表面可得较高纯度的氮化硅,该反应的化学方程式为3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.
③Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中进行热处理的过程中,除生成Mg3N2外,还可能生成SiO2物质(填化学式).热处理后除去MgO和Mg3N2的方法是加足量稀盐酸过滤.
| A. | 纯碱 | B. | 明矾 | C. | 蔗糖 | D. | 火碱 |
| A. | 常温下,50g SO2和CO2的混合气体中可能含有2NA个氧原子 | |
| B. | I mol Cl2与足量的铁反应,转移的电子数为3NA | |
| C. | 1 L0.1 mol•L-1氨水含有0.l NA个OH- | |
| D. | I mol乙醇中含有C-H键的数目为6NA |
| A. | 前者小于后者 | B. | 前者大于后者 | C. | 前者等于后者 | D. | 不能确定 |
| A. | NH3•H2O | B. | Mg(OH)2 | C. | Na2CO3 | D. | MgCO3 |
| A. | 羊毛 | B. | 棉线 | C. | 涤纶 | D. | 真丝巾 |