��Ŀ����
19��Ϊ̽����ҵ����������ͭ�Ͻ���ϵ������ã���ͬѧ��Ƶ�ʵ�鷽����ͼ��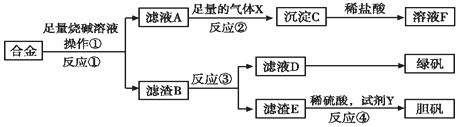
��ش�
��1���������õ��IJ����������ձ���©������������
��2��д����Ӧ�ٵĻ�ѧ����ʽ��2Al+2NaOH+6H2O=2Na[Al��OH��4]+3H2������Ӧ�ڵ����ӷ�Ӧ����ʽ��[Al��OH��4]-+CO2�TAl��OH��3��+HCO3-��
��3�����ʵ�鷽���������ҺD�к��еĽ������ӣ��Լ���ѡ��ȡ������ҺD����NaOH��Һ��������ɫ����������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��
��4��������E�м���ϡ������Լ�Y�Ƶ���������һ����ɫ��ѧ���գ��Լ�YΪ��ɫҺ�壬��Ӧ�ܵ��ܻ�ѧ����ʽ��Cu+H2O2+H2SO4+3H2O=CuSO4•5H2O��Cu+H2O2+H2SO4=CuSO4+2H2O��
��5����ͬѧ�ڼ�ͬѧ�����Ļ��������������B���Ʊ�FeCl3•6H2O���壬�������еμ�����ʱ�����ַ�Ӧ���ʱ�ͬŨ�������봿���۷�ӦҪ�죬��ԭ����ͭ������ϡ�����γ���ԭ��أ�
��6��������B�ľ��Ȼ����ƽ���ֳ��ĵȷݣ��ֱ����ͬŨ�ȵ�ϡ���ᣬ��ַ�Ӧ���ڱ�״��������NO�������ʣ�����������������������Ļ�ԭ����ֻ��NO����
| ʵ���� | �� | �� | �� | �� |
| ϡ���������mL�� | 100 | 200 | 300 | 400 |
| ʣ�����������g�� | 9.0 | 4.8 | 0 | 0 |
| NO�����L�� | 1.12 | 2.24 | 3.36 | 4.48 |
���� ���ݽ��������ʽ�Ͽ�ͼת����ϵ�����ò�Ʒѡ����ʵ��Լ�������ҺA����ҺF��AlCl3����֪����ҺA�к����ܽ����Ԫ�أ������������ᷴӦ����Ӧ��֪����������������Һ��Ӧ������ͭ���������Ʋ���Ӧ����������BΪ����ͭ�����ݲ�Ʒ�̷�����Ӧ��Ϊϡ����������Ӧ��������ҺEΪ����������Һ������FΪͭ��ͭ������ͭ������Ũ������ͭ������ȡ�����������Ⱦ��������������Բ���ͭ��������������һ��Ӧ��������ͭ�ķ�����
��1�����й��˲���ʱ�����õ��IJ���������Ҫ���ձ���©������������
��2�����������Ժ�ǿ�����Ӧ����ƫ�����κ�������ƫ�����ο��ԺͶ�����̼���巴Ӧ������������������
��3�������������ӵļ��鷽�����ش�
��4��˫��ˮ��һ����ɫ������������ʵ�ֽ���ͭ������֮��ķ�Ӧ��
��5��������B�еμ�����ʱ����Һ��ͭ�����������γ���ԭ��أ�
��6������100mL����ʱ��������ʣ�࣬˵�������ܽ����ɶ���������������ȫ��Ӧ������������NO��n��NO��=$\frac{1.12L}{22.4L/mol}$=0.05mol������NO����������֮��Ĺ�ϵʽΪ2NO----8HNO3���ݴ˼�������Ũ�ȣ�
��100-200mLʱ���ܽ��������=9.0g-4.8g=4.2g��������ʣ�࣬˵�����ɵĽ����������Ƕ��������ӣ�����n��NO��=$\frac{2.24-1.12}{22.4}$=0.05mol������ת�Ƶ����غ��n��������=$\frac{0.05mol����5-2��}{2-0}$=0.075mol������ƽ��Ħ������=$\frac{4.2g}{0.075mol}$=56g/mol�������ܽ����Fe����0-100mL�ܽ������100-200mL�ܽ����������ȣ�����0-100mL�ܽ��FeΪ8.4g��200-300mLʱ���ܽ��������=4.8-0=4.8������n��NO=0.05mol�����ܽ����ȫ��ͭ��
����ת�Ƶ����غ��n��������=$\frac{0.05mol����5-2��}{2-0}$=0.075mol������ƽ��Ħ������=$\frac{4.8g}{0.075mol}$=64g/mol��
��� �⣺��1�������ٹ��ˣ��˲���ʱ�����õ��IJ���������Ҫ���ձ���©�������������ʴ�Ϊ���ձ���©������������
��2���ٽ��������Ժ�ǿ���������Ʒ�����Ӧ�������ǻ��������ƺ���������2Al+2NaOH+6H2O=2Na[Al��OH��4]+3H2�����ʴ�Ϊ��2Al+2NaOH+6H2O=2Na[Al��OH��4]+3H2����
�����ǻ�����������ͨ�������̼������ԺͶ�����̼���巴Ӧ��������������������[Al��OH��4]-+CO2�TAl��OH��3��+HCO3-���ʴ�Ϊ��[Al��OH��4]-+CO2�TAl��OH��3��+HCO3-��
��3���������ӿ��Ժ�ǿ�Ӧ��������������������Ѹ�ٱ�����Ϊ�������������������ӵļ��鷽����ȡ������ҺD����NaOH��Һ��������ɫ����������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ���ʴ�Ϊ��ȡ������ҺD����NaOH��Һ��������ɫ����������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��
��4��˫��ˮ��һ����ɫ����������˫��ˮ�������£�����ͭ���Ժ����ᷢ����Ӧ��Cu+H2O2+H2SO4+3H2O=CuSO4•5H2O��Cu+H2O2+H2SO4=CuSO4+2H2O���ʴ�Ϊ��Cu+H2O2+H2SO4+3H2O=CuSO4•5H2O��Cu+H2O2+H2SO4=CuSO4+2H2O��
��5��������B�еμ�����ʱ����Һ��ͭ�����������γ�������С��ԭ��أ������˵绯ѧ��ʴ���ӿ��˷�Ӧ���ʣ��ʴ�Ϊ��ͭ������ϡ�����γ���ԭ��أ�
��6������100mL����ʱ��������ʣ�࣬˵�������ܽ����ɶ���������������ȫ��Ӧ������������NO��n��NO��=$\frac{1.12L}{22.4L/mol}$=0.05mol������NO����������֮��Ĺ�ϵʽΪ2NO----8HNO3��c��HNO3��=$\frac{n}{V}$=$\frac{0.05��4}{0.1}$=2mol/L��
�ʴ�Ϊ�������Ũ��Ϊ2mol/L��
��100-200mLʱ���ܽ��������=9.0g-4.8g=4.2g��������ʣ�࣬˵�����ɵĽ����������Ƕ��������ӣ�����n��NO��=$\frac{2.24-1.12}{22.4}$=0.05mol������ת�Ƶ����غ��n��������=$\frac{0.05mol����5-2��}{2-0}$=0.075mol������ƽ��Ħ������=$\frac{4.2g}{0.075mol}$=56g/mol�������ܽ����Fe����0-100mL�ܽ������100-200mL�ܽ����������ȣ�����0-100mL�ܽ��FeΪ8.4g��200-300mLʱ���ܽ��������=4.8-0=4.8������n��NO=0.05mol�����ܽ����ȫ��ͭ��
����ת�Ƶ����غ��n��������=$\frac{0.05mol����5-2��}{2-0}$=0.075mol������ƽ��Ħ������=$\frac{4.8g}{0.075mol}$=64g/mol�������ܽ����ȫ��Cu�����Ԣ����ܽ��Cu������Ϊ4.8g��
�ʴ�Ϊ�������ܽ��Cu������Ϊ4.8g��
���� ����Ϊ���������⣬�漰�����Ļ��ա�����������������ԭ��Ӧ�����ʵķ����ᴿ�ͳ��ӵ����⣬��Ŀ��Ϊ�ۺϣ�����ʱע����ϸ���⣬����Ŀ�л�ȡ�ؼ���Ϣ�������Ѷ��У�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
Ŀ�����ϵ�д�| A�� | Q �� W�����γ� 10���ӡ�14���ӡ�18 ���ӷ��� | |
| B�� | Y ������������Ӧˮ����Ļ�ѧʽֻ�ܱ�ʾΪ H4YO4 | |
| C�� | Y��Z��Q �ֱ��� X ���ϣ�ֻ���γ� AB2�ͻ����� | |
| D�� | X��Z��W �е����ֻ�����Ԫ���γɵ�������Һ���������ԡ����ԡ����� |
| A�� | �ƾ���ˮ | B�� | ������Ȼ�̼ | C�� | ˮ�����Ȼ�̼ | D�� | �������������� |
| ��ʼŨ�� | �� | �� | �� |
| c��NO2��/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c��SO2��/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A�� | �������еķ�Ӧ��ǰ2min��ƽ������v��SO2��=0.05mol•L-1•min-1 | |
| B�� | �ﵽƽ��ʱ��������������Ӧ��������������� | |
| C�� | �¶�����90�棬������Ӧƽ�ⳣ��Ϊ1.56����Ӧ�ġ�H��0 | |
| D�� | ������������ʼʱ�ij�0.10mol•L-1NO2��0.20mol•L-1SO2���ﵽƽ��ʱc��NO����ԭƽ�ⲻ��ͬ |
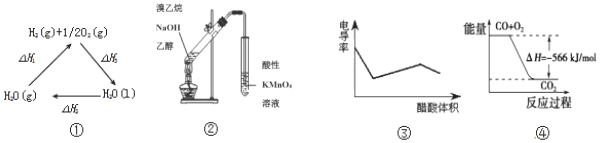
| A�� | ͼ���С�H1=��H2+��H3 | |
| B�� | ͼ�ڿ�����֤��ʵ������������ϩ | |
| C�� | ͼ�۱�ʾ������Һ�ζ� NaOH �Ͱ�ˮ�����Һ�ĵ絼�ʱ仯���� | |
| D�� | ͼ�ܿɱ�ʾ��CO��g������CO2��g���Ĺ�����Ҫ�ų�566kJ ���� |
| A�� | ��һ�����ܣ�F��O��N | |
| B�� | ���Ӿ�����һ���������Ӽ� | |
| C�� | CCl4��NH3�����Լ��Լ���ϵļ��Է��� | |
| D�� | ����Ϊ���Ӿ��壬���ӽṹΪ�������壬�����Ϊ109.5�� |
| A�� | S2Cl2�ĽṹʽΪCl-S-S-Cl | |
| B�� | S2Cl2��Sԭ�ӵ��ӻ�����Ϊsp2�ӻ� | |
| C�� | S2Cl2�����и�ԭ�Ӻ����������Ӿ��ﵽ8�����ȶ��ṹ | |
| D�� | S2Cl2��H2O��Ӧ�Ļ�ѧ����ʽ����Ϊ��2S2Cl2+2H2O�TSO2��+3S��+4HCl |