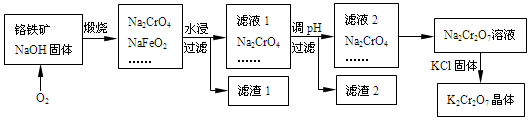
题目内容
7.X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍;X与 Z同族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W 与 X、Y 既不同族也不同周期且 W 不为稀有气体元素; X、Y、Z 三种元素的族序数之和为16.下列说法正确的是( )| A. | Q 与 W不能形成 10电子、14电子、18 电子分子 | |
| B. | Y 的最高价氧化物对应水化物的化学式只能表示为 H4YO4 | |
| C. | Y、Z、Q 分别与 X 化合,只能形成 AB2型化合物 | |
| D. | X、Z、W 中的两种或三种元素形成的钠盐溶液可能显酸性、碱性、中性 |
分析 X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍,X为O元素;X与Z同族,Z为S元素;Q原子的电子总数等于其电子层数的3倍,Q的电子层数为2时,电子总数为6,则Q为C元素;W 与 X、Y 既不同族也不同周期且 W 不为稀有气体元素,则W为H; X、Y、Z 三种元素的族序数之和为16,Y的族序数为16-6-6=4,Y与Z同周期,Y为Si元素,以此来解答.
解答 解:由上述分析可知,X为O,Y为Si,Z为S,W为H,Q为C,
A.Q 与 W能形成 10电子(CH4)、14电子(C2H2)、18 电子(C2H6)分子,故A错误;
B.Y为Si,的最高价氧化物对应水化物的化学式表示为H2YO3或 H4YO4,故B错误;
C.Y、Z、Q 分别与 X 化合,能形成 AB2型化合物,且Z与X可形成SO3,Q与X可形成CO,故C错误;
D.X、Z、W 中的两种或三种元素形成的钠盐溶液可能显酸性、碱性、中性,如硫酸氢钠、亚硫酸钠、硫酸钠,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
17.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol |
18.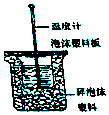 Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量不相等(填“相等”或“不相等”),但中和热应相等(填“相等”或“不相等”).
(4)记录的实验数据如表:
已知:Q=cm(t2-t1),反应后溶液的比热容C为4.18KJ•℃-1•Kg-1,各物质的密度均为1g•cm-3.根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ•mol-1
过氧化氢是重要的氧化剂,也可作还原剂,它的水溶液称为双氧水,常用于消毒、杀菌、漂白等.某化学研究性学习小组取一定量的市售过氧化氢溶液测定其中H2O2的含量,并探究它的有关性质.
Ⅱ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用酸式滴定管(填“酸式滴定管”或“碱式滴定管”);
(2)将上述溶液配制成250.00mL,配制过程需用到的玻璃仪器是烧杯、玻璃棒、250 mL容量瓶、胶头滴管(填名称);
(3)取25.00mL(2)中的溶液于锥形瓶中,用稀H2SO4酸化,并加适量蒸馏水稀释,用高锰酸钾标准液滴定.
①完成反应的离子方程式:
2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
②重复滴定三次,平均消耗C mol/L KMnO4标准液V mL,则原过氧化氢溶液中H2O2的质量分数为$\frac{17CV}{200ρ}$.
 Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量不相等(填“相等”或“不相等”),但中和热应相等(填“相等”或“不相等”).
(4)记录的实验数据如表:
| 实验用品 | 溶液温度 | |||
| t1 | t2 | |||
| ① | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.3℃ |
| ② | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.5℃ |
| 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 21.5℃ | |
过氧化氢是重要的氧化剂,也可作还原剂,它的水溶液称为双氧水,常用于消毒、杀菌、漂白等.某化学研究性学习小组取一定量的市售过氧化氢溶液测定其中H2O2的含量,并探究它的有关性质.
Ⅱ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用酸式滴定管(填“酸式滴定管”或“碱式滴定管”);
(2)将上述溶液配制成250.00mL,配制过程需用到的玻璃仪器是烧杯、玻璃棒、250 mL容量瓶、胶头滴管(填名称);
(3)取25.00mL(2)中的溶液于锥形瓶中,用稀H2SO4酸化,并加适量蒸馏水稀释,用高锰酸钾标准液滴定.
①完成反应的离子方程式:
2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
②重复滴定三次,平均消耗C mol/L KMnO4标准液V mL,则原过氧化氢溶液中H2O2的质量分数为$\frac{17CV}{200ρ}$.
15.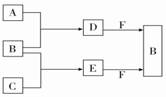 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )
 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )| A. | F中阴阳离子个数比为1:1 | |
| B. | 化合物F中既有离子键又有共价键 | |
| C. | 合成过程中的反应均是氧化还原反应 | |
| D. | 1mol F与E反应时转移的电子数为NA(NA为阿伏伽德罗常数的值) |
12.下列各组物质中,不是按 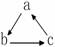 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | HNO2 | CH2=CH2 | NaOH | Fe |
| b | NO | CH3CH2Br | NaHCO3 | FeCl3 |
| c | NO2 | CH3CH2OH | Na2CO3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
19.为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如图:
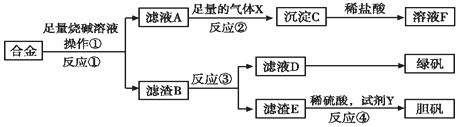
请回答:
(1)操作①用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)写出反应①的化学方程式:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,反应②的离子反应方程式:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-.
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色.
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是Cu+H2O2+H2SO4+3H2O=CuSO4•5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O.
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3•6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是铜、铁与稀硫酸形成了原电池.
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见表(设硝酸的还原产物只有NO).
则硝酸的浓度为2mol/L;③中溶解铜的质量为4.8g.

请回答:
(1)操作①用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)写出反应①的化学方程式:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,反应②的离子反应方程式:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-.
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色.
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是Cu+H2O2+H2SO4+3H2O=CuSO4•5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O.
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3•6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是铜、铁与稀硫酸形成了原电池.
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见表(设硝酸的还原产物只有NO).
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | 4.48 |
16.CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是( )
| A. | CO全部转化为乙醇 | |
| B. | 断4NA个H-H键的同时,生成46g乙醇 | |
| C. | 若反应在恒温密闭容器中进行,容器中混合气体的密度不再改变 | |
| D. | 若反应在绝热密闭容器中进行,容器中温度不再改变 |
 根据要求回答问题:
根据要求回答问题: .
. .分子中可能处于同一平面上的碳原子最多有4个.
.分子中可能处于同一平面上的碳原子最多有4个.