题目内容
14.下列各组混合物中,能用过滤的方法进行分离的是( )| A. | 酒精和水 | B. | 碘和四氯化碳 | C. | 水和四氯化碳 | D. | 混有泥土的蔗糖 |
分析 不溶性固体与液体可选择过滤的方法进行分离,以此来解答.
解答 解:A.二者互溶,沸点不同,选蒸馏法分离,故A不选;
B.二者互溶,沸点不同,选蒸馏法分离,故B不选;
C.水和四氯化碳分层,选择分液法分离,故C不选;
D.泥土不溶于水,则过滤法可分离,故D选;
故选D
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法选择、实验技能为解答的关键,侧重分析与实验能力的考查,注意分离方法的选择,题目难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
4.利用实验器材(规格和数量不限)能完成相应实验的一项是( )
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、蒸发皿 | CuSO4溶液的浓缩结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去BaSO4中少量BaCO3 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体NaCl配制0.5mol•L-1的溶液 |
| D | 烧杯、分液漏斗 | 用CCl4分离碘水中的碘 |
| A. | A | B. | B | C. | C | D. | D |
5.室温下向10mLpH=3的醋酸溶液中加入水稀释后.下列说法正确的是( )
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中醋酸根浓度与醋酸分了浓度比值变大 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液的导电能力增强 |
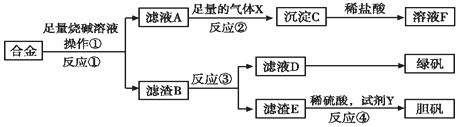
19.为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如图:
请回答:
(1)操作①用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)写出反应①的化学方程式:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,反应②的离子反应方程式:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-.
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色.
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是Cu+H2O2+H2SO4+3H2O=CuSO4•5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O.
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3•6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是铜、铁与稀硫酸形成了原电池.
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见表(设硝酸的还原产物只有NO).
则硝酸的浓度为2mol/L;③中溶解铜的质量为4.8g.

请回答:
(1)操作①用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)写出反应①的化学方程式:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,反应②的离子反应方程式:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-.
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色.
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是Cu+H2O2+H2SO4+3H2O=CuSO4•5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O.
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3•6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是铜、铁与稀硫酸形成了原电池.
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见表(设硝酸的还原产物只有NO).
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | 4.48 |
3.800℃时,反应CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数K=1,现向某一密闭容器中充入1.2molCO和0.6mol H2O(g)发生反应,一定时间后达到化学平衡状态,保持温度不变,下列说法正确的是( )
| A. | 再充入等物质的量的CO2和H2达到新的平衡状态,CO的体积分数不变 | |
| B. | 再向容器中再充入1molCO,平衡正向移动,H2的体积分数增大 | |
| C. | 若起始时充入1.2mol H2O(g)和0.6mol CO,达到平衡时H2的体积分数不变 | |
| D. | 若起始时充入0.9mol H2O(g)、0.6mol CO、0.7mol CO2和0.8molH2,则此时υ正=υ逆 |
4.实验室模拟工业制备高纯铁.用惰性电极电解FeSO4溶液制备高纯铁的原理如图所示. 下列说法不正确的是( )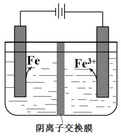

| A. | 阴极主要发生反应:Fe2++2e-═Fe | |
| B. | 向阳极附近滴加KSCN溶液,溶液变红 | |
| C. | 电解一段时间后,阴极附近pH减小 | |
| D. | 电解法制备高纯铁总反应:3Fe2+$\frac{\underline{\;电解\;}}{\;}$Fe+2Fe3+ |
 根据要求回答问题:
根据要求回答问题: .
. .分子中可能处于同一平面上的碳原子最多有4个.
.分子中可能处于同一平面上的碳原子最多有4个.
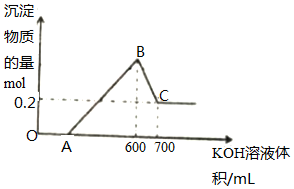 将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体.向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体.向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示: