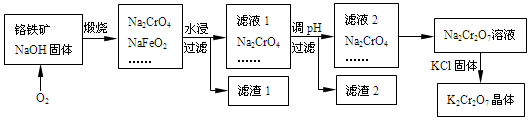
题目内容
8.下列叙述正确的是( )| A. | 第一电离能:F>O>N | |
| B. | 离子晶体中一定存在离子键 | |
| C. | CCl4和NH3都是以极性键结合的极性分子 | |
| D. | 白磷为分子晶体,分子结构为正四面体,其键角为109.5° |
分析 A.同周期,随原子序数增大第一电离能增大,但N原子的2p电子半满为稳定结构;
B.离子键仅存在于离子化合物中;
C.CCl4为极性分子;
D.白磷键角为60°.
解答 解:A.同周期,随原子序数增大第一电离能增大,但N原子的2p电子半满为稳定结构,则第一电离能F>N>O,故A错误;
B.离子键仅存在于离子化合物中,离子晶体一定含有离子键,故B正确;
C.CCl4结构对称,正负电荷重心重叠,为非极性分子,故C错误;
D.白磷为分子晶体,分子结构为正四面体,但键角为60°,故D错误.
故选B.
点评 本题考查元素性质的比较,为高频考点,把握非金属性与电负性、第一电离能的关系及分子的极性、键角判断方法为解答的关键,侧重规律性知识的考查,注意元素周期表和周期律的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.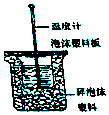 Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量不相等(填“相等”或“不相等”),但中和热应相等(填“相等”或“不相等”).
(4)记录的实验数据如表:
已知:Q=cm(t2-t1),反应后溶液的比热容C为4.18KJ•℃-1•Kg-1,各物质的密度均为1g•cm-3.根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ•mol-1
过氧化氢是重要的氧化剂,也可作还原剂,它的水溶液称为双氧水,常用于消毒、杀菌、漂白等.某化学研究性学习小组取一定量的市售过氧化氢溶液测定其中H2O2的含量,并探究它的有关性质.
Ⅱ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用酸式滴定管(填“酸式滴定管”或“碱式滴定管”);
(2)将上述溶液配制成250.00mL,配制过程需用到的玻璃仪器是烧杯、玻璃棒、250 mL容量瓶、胶头滴管(填名称);
(3)取25.00mL(2)中的溶液于锥形瓶中,用稀H2SO4酸化,并加适量蒸馏水稀释,用高锰酸钾标准液滴定.
①完成反应的离子方程式:
2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
②重复滴定三次,平均消耗C mol/L KMnO4标准液V mL,则原过氧化氢溶液中H2O2的质量分数为$\frac{17CV}{200ρ}$.
 Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量不相等(填“相等”或“不相等”),但中和热应相等(填“相等”或“不相等”).
(4)记录的实验数据如表:
| 实验用品 | 溶液温度 | |||
| t1 | t2 | |||
| ① | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.3℃ |
| ② | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.5℃ |
| 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 21.5℃ | |
过氧化氢是重要的氧化剂,也可作还原剂,它的水溶液称为双氧水,常用于消毒、杀菌、漂白等.某化学研究性学习小组取一定量的市售过氧化氢溶液测定其中H2O2的含量,并探究它的有关性质.
Ⅱ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用酸式滴定管(填“酸式滴定管”或“碱式滴定管”);
(2)将上述溶液配制成250.00mL,配制过程需用到的玻璃仪器是烧杯、玻璃棒、250 mL容量瓶、胶头滴管(填名称);
(3)取25.00mL(2)中的溶液于锥形瓶中,用稀H2SO4酸化,并加适量蒸馏水稀释,用高锰酸钾标准液滴定.
①完成反应的离子方程式:
2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
②重复滴定三次,平均消耗C mol/L KMnO4标准液V mL,则原过氧化氢溶液中H2O2的质量分数为$\frac{17CV}{200ρ}$.
19.为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如图:
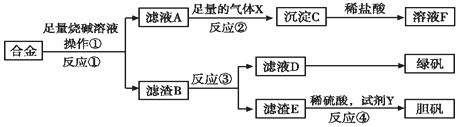
请回答:
(1)操作①用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)写出反应①的化学方程式:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,反应②的离子反应方程式:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-.
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色.
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是Cu+H2O2+H2SO4+3H2O=CuSO4•5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O.
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3•6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是铜、铁与稀硫酸形成了原电池.
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见表(设硝酸的还原产物只有NO).
则硝酸的浓度为2mol/L;③中溶解铜的质量为4.8g.

请回答:
(1)操作①用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)写出反应①的化学方程式:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,反应②的离子反应方程式:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-.
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色.
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是Cu+H2O2+H2SO4+3H2O=CuSO4•5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O.
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3•6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是铜、铁与稀硫酸形成了原电池.
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见表(设硝酸的还原产物只有NO).
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | 4.48 |
16.CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是( )
| A. | CO全部转化为乙醇 | |
| B. | 断4NA个H-H键的同时,生成46g乙醇 | |
| C. | 若反应在恒温密闭容器中进行,容器中混合气体的密度不再改变 | |
| D. | 若反应在绝热密闭容器中进行,容器中温度不再改变 |
3.800℃时,反应CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数K=1,现向某一密闭容器中充入1.2molCO和0.6mol H2O(g)发生反应,一定时间后达到化学平衡状态,保持温度不变,下列说法正确的是( )
| A. | 再充入等物质的量的CO2和H2达到新的平衡状态,CO的体积分数不变 | |
| B. | 再向容器中再充入1molCO,平衡正向移动,H2的体积分数增大 | |
| C. | 若起始时充入1.2mol H2O(g)和0.6mol CO,达到平衡时H2的体积分数不变 | |
| D. | 若起始时充入0.9mol H2O(g)、0.6mol CO、0.7mol CO2和0.8molH2,则此时υ正=υ逆 |
13.下列说法中正确的是( )
| A. | 乙烯中 C=C 的键能是乙烷中 C-C 的键能的 2 倍 | |
| B. | 同一原子中,2p,3p,4p 能级的轨道数目依次增多 | |
| C. | C-O 键的极性比 N-O 键的极性大 | |
| D. | 根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |
20.W、X、Y、Z均是短周期元素,X、Y、Z处于同一周期,W、X、Z的简单离子具有相同的电子层结构,W的最高氧化物的水化物可与其最简单的气态氢化物反应生成易溶于水的盐,X的氧化物具有两性,Y的最高正价与最低负价的代数和为0,下列说法正确的是( )
| A. | 离子半径:W>Z>X | B. | 单质熔点:W>Z | ||
| C. | 最高正价:W>X>Y>Z | D. | 原子序数:Z>W>X>Y |
4.卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它为原料按图所示工艺流程进行生产,可制得轻质氧化镁.

若要求产品尽量不含杂质,而且生产成本较低,根据以下资料,填写空白:
已知:
1、25℃,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=8.0×10-16,
Ksp[Mg(OH)2]=1.8×10-11,Ksp[Mn(OH)2]=4.0×10-14.
2、Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去.
3、原料价格表
(1)请设计实验证明卤块中既含有Fe3+又有Fe2+取样,加水溶解,将溶液分成两份,往其中一份滴加硫氰化钾溶液,若溶液变红,则说
明卤块中含铁离子,往另一份溶液中滴加酸性高锰酸钾溶液,若酸性高锰酸钾溶液褪色,则说明含亚铁离子.
(2)在步骤②中加入的试剂X,最佳的选择是漂液(NaClO),其作用是使溶液中Fe2+氧化成为Fe3+,便于除去.
(3)在步骤③中加入的试剂Y应是烧碱(NaOH),步骤⑥中发生的反应是Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$H2O+MgO.
(4)请写出氧化镁的一种用途:耐火材料、食品添加剂、抗酸剂、催化剂、制造镁盐的原料等,步骤⑥如在实验室进行,应选用在坩埚(填仪器名称)中灼烧.
(5)25℃,往卤块对应的水溶液中,加入一定量的烧碱达到沉淀溶液平衡,当pH=3,c(Fe3+)沉淀完全.测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=1×10-8mol/L.

若要求产品尽量不含杂质,而且生产成本较低,根据以下资料,填写空白:
已知:
1、25℃,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=8.0×10-16,
Ksp[Mg(OH)2]=1.8×10-11,Ksp[Mn(OH)2]=4.0×10-14.
2、Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去.
3、原料价格表
| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
明卤块中含铁离子,往另一份溶液中滴加酸性高锰酸钾溶液,若酸性高锰酸钾溶液褪色,则说明含亚铁离子.
(2)在步骤②中加入的试剂X,最佳的选择是漂液(NaClO),其作用是使溶液中Fe2+氧化成为Fe3+,便于除去.
(3)在步骤③中加入的试剂Y应是烧碱(NaOH),步骤⑥中发生的反应是Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$H2O+MgO.
(4)请写出氧化镁的一种用途:耐火材料、食品添加剂、抗酸剂、催化剂、制造镁盐的原料等,步骤⑥如在实验室进行,应选用在坩埚(填仪器名称)中灼烧.
(5)25℃,往卤块对应的水溶液中,加入一定量的烧碱达到沉淀溶液平衡,当pH=3,c(Fe3+)沉淀完全.测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=1×10-8mol/L.