题目内容
3.某课外实验小组设计的下列实验合理的是( ) 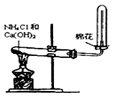 | 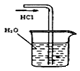 | 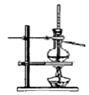 | 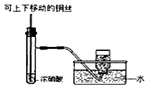 |
| A.制备少量氨气 | B.吸收HCl | C.分离苯和乙醇的混合物 | D.制备并收集少量NO2气体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化铵与氢氧化钙加热反应生成氨气,氨气的密度比空气的密度小;
B.HCl极易溶于水;
C.温度计位置错误;
D.二氧化氮与水反应,不能排水法收集.
解答 解:A.氯化铵与氢氧化钙加热反应生成氨气,氨气的密度比空气的密度小,则选向下排空气法收集,试管口塞棉花,防止与空气对流,故A正确;
B.HCl极易溶于水,则图中导管在液面下极易发生倒吸,故B错误;
C.温度计用于测量馏分的温度,应位于蒸馏烧瓶的支管口附近,故C错误;
D.二氧化氮与水反应,不能排水法收集,应选向上排空气法收集,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的制备实验、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
相关题目
14.为了除去KC1固体中少量MgSO4和CaCl2杂质.某同学进行了下列七项操作,正确的操作顺序是( )
①加水溶解 ②加热蒸发得到晶体 ③加入过量BaCl2溶液 ④加入过量盐酸 ⑤加入过量K2CO3⑥过滤 ⑦加入过量KOH.
①加水溶解 ②加热蒸发得到晶体 ③加入过量BaCl2溶液 ④加入过量盐酸 ⑤加入过量K2CO3⑥过滤 ⑦加入过量KOH.
| A. | ①⑤③⑦⑥④② | B. | ①⑤⑦③④⑥② | C. | ①⑦③⑤⑥④② | D. | ①⑦③④⑥⑤② |
11.已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
| A. | 1molCO 完全燃烧,放出热量为 283 J | |
| B. | Na2O2(s)+CO2(s)=Na2CO3(s)+$\frac{1}{2}$ O2(g)△H=-226 kJ•mol-1 | |
| C. | CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 1.204×1024 | |
| D. | CO 的燃烧热为 566 kJ•mol-1 |
18.下列离子方程式书写正确的是( )
| A. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 向Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 硫代硫酸钠溶液中加入硫酸:S2O32-+6H++2SO42-═4SO2↑+3H2O | |
| D. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O |
8.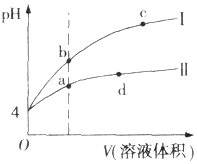 常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
 常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | pH=4的HCl溶液中H2O电离出的c(H+)=10-4 mol.L-1 | |
| B. | 曲线I为CH3COOH溶液的稀释曲线 | |
| C. | a、d点溶液和NaOH溶液完全反应时消耗的NaOH的物质的量相等 | |
| D. | a、b、c三点溶液中Kw:c=b<a |
12.下列叙述中,不能用平衡移动原理解释的是( )
| A. | 红棕色的NO2气体,加压后颜色先变深后变浅 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 氯气在水中溶解度大于饱和食盐水中的溶解度 | |
| D. | 由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深 |
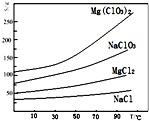 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2•6H2O的流程如下:
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2•6H2O的流程如下: