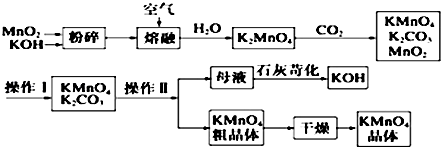
题目内容
3.为了测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:A.冷却至室温后,在250mL容量瓶中定容配成250mL稀硫酸.
B.用某仪器量取25.00mL稀硫酸于锥形瓶中并滴入几滴指示剂.
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗.
D.将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面记下开始读数为V1mL.
E.小心滴入NaOH标准溶液,边滴边摇动锥形瓶,滴定至恰好反应为止,记下读数为V2mL.
F.把锥形瓶移到碱式滴定管下,在锥形瓶下垫一张白纸.
G.用某仪器准确量取浓硫酸样品10.00mL,在烧杯中用蒸馏水溶解.
请完成下列填空:
(1)正确操作步骤的顺序(用编号字母填写)G A C B D F E.
(2)用来量取10.00mL浓硫酸的仪器是酸式滴定管,用NaOH溶液润洗碱式滴定管的目的是保证标准液浓度不被稀释.
(3)滴定中可选用的指示剂是酚酞(或甲基橙),滴定中,目光应注视锥形瓶中溶液颜色的变化.
(4)某学生实验时用稀硫酸润洗了锥形瓶测定的浓度会偏偏高.(填“偏高”、“偏低”或“无影响”)
分析 (1)根据滴定的实验操作进行排序;
(2)准确量取10.00mL浓硫酸,需要用精密量具,精确到0.1,估读到0.01,所以学过的量具中,滴定管、移液管是能精确计量的仪器,注意溶液的碱性;未用标准液润洗碱式滴定管,标准液碱的浓度偏小;
(3)根据强酸强碱盐呈中性,应选择酸性或碱性范围内变色的指示剂,如甲基橙或酚酞;根据滴定过程中,目光应注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达;
(4)根据c(待测)=$\frac{c(标准)c(待测)}{V待测}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)用酸式滴定管准确量取浓硫酸样品10.00mL,在烧杯中用蒸馏水溶解,冷却至室温后,在250mL容量瓶中定容配成250mL稀硫酸,用移液管移取25.00mL稀硫酸于锥形瓶中并滴入几滴指示剂,将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面,记下开始读数为V1,在锥形瓶下垫一张白纸,滴定至终点,记下读数V2,故正确的操作顺序为:G A C B D F E;故答案为:G A C B D F E;
(2)酸式滴定管可以精确到0.01mL,硫酸具有酸性,能用酸式滴定管来量取;未用标准液润洗碱式滴定管,标准液碱的浓度偏小,所以NaOH溶液润洗碱式滴定管的目的是保证标准液浓度不被稀释;
故答案为:酸式滴定管;保证标准液浓度不被稀释;
(3)硫酸和氢氧化钠反应生成硫酸钠,硫酸钠溶液呈中性,应选择酸性或碱性范围内变色的指示剂,如甲基橙或酚酞;在滴定过程中,目光应注视锥形瓶中溶液颜色的变化,故答案为:酚酞(或甲基橙);锥形瓶中溶液颜色的变化;
(4)实验时用稀硫酸润洗了锥形瓶,待测液的物质的量偏大,造成V(标准)偏高,根据c(待测)=$\frac{c(标准)c(待测)}{V待测}$分析,可知c(标准)偏高,故答案为:偏高.
点评 本题主要考查了滴定操作、指示剂的选择、误差分析等,难度不大,根据课本知识即可完成.

 阅读快车系列答案
阅读快车系列答案| A. | 红棕色的NO2气体,加压后颜色先变深后变浅 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 氯气在水中溶解度大于饱和食盐水中的溶解度 | |
| D. | 由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深 |
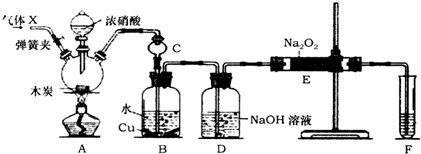
已知:①3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+.
具体操作:如图连接装置,检验气密性后,装入药品.实验开始前先通入常见气体X一段时间,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡,直至E中淡黄色粉末完全变为白色固体.
(1)气体X的化学式为N2,其作用是排尽系统内空气,以免生成的一氧化氮被空气中的氧气氧化.
(2)上述装置中,仪器C的作用是防止B中溶液倒吸.B中观察到的主要现象是铜片减小、溶液变蓝色、有气泡冒出.
(3)该活动小组制取的NaNO2产品不纯,杂质为NaOH(填化学式);为提高产品的纯度,对上述实验装置进行的改进是装置DE之间和装置EF之间添加干燥装置.
(4)请设计实验证明产品中含有NO2-取少量E中白色固体加入稀盐酸产生无色气体,遇到空气变化为红棕色证明固体中含有亚硝酸根离子(简述实验操作、现象和结论).
(5)称取该小组产品4.5g溶于水配成500mL溶液,取50mL溶液于锥形瓶中,用0.1000mol•L-1的酸性KMnO4溶液进行滴定,实验数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.80 | 20.01 | 20.00 | 19.99 |
a.酸式滴定管未用标准液润洗
b.锥形瓶用水洗净后又用待测液润洗
c.滴定前仰视读数,滴定终点平视读数
d.滴定结束后滴定管尖嘴处仍悬有液滴
根据表中数据,计算产品中亚硝酸钠的质量分数76.7%.
已知:Na2S2O3在酸性溶液中不能稳定存在.有关物质的溶解度随温度变化曲线如图2所示.某研究小组设计了制备Na2S2O3•5H2O的装置图(如图1).
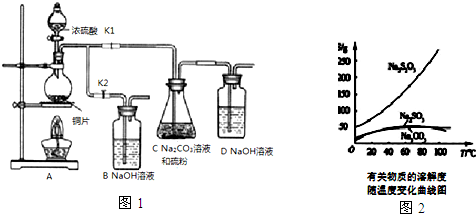
部分操作步骤如下:
①打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热.
②C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时,即停止C中的反应,停止加热
③过滤C中的混合液,并将滤液进行处理,得到产品.
(1)步骤①中,圆底烧瓶中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)步骤②中,“当C中溶液的pH接近7时即停止C中的反应”的原因是Na2S2O3在酸性溶液中不能稳定存在.“停止C中的反应”的操作是打开K2,关闭K1.
(3)步骤③中,“过滤”用到的玻璃仪器是烧杯、漏斗、玻璃棒(填仪器名称).将滤液进行处理过程是将滤液经过加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
依据反应2S2O32-+I2→S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如表所示.
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
(5)Na2S2O3•5H2O在产品中的质量分数是90.2%.(计算结果请用百分数表示并保留1位小数)(Na2S2O3•5H2O的式量为248)
| 时间 | 开始 | 8小时 | 16小时 | 24小时 | 32小时 | 40小时 | 48小时 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(2)pH变化的离子方程式:2H2SO3+O2=4H++SO42-.
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线: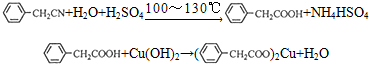
 已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:
已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验: