题目内容
8.下列各组中属于同位素关系的是( )| A. | ${\;}_{19}^{40}K$与${\;}_{20}^{40}Ca$ | B. | D2O与T2O | ||
| C. | ${\;}_{19}^{40}K$与${\;}_{19}^{39}K$ | D. | 白磷与红磷 |
分析 若把原子表示为$\underset{\stackrel{A}{\;}}{Z}\underset{\stackrel{\;}{X}}{\;}$,X表示元素符号,Z代表质子数,A代表质量数,质子数+中子数=质量数,质子数相同中子数不同的同一元素的不同原子互称为同位素,以此来解答.
解答 解:A.${\;}_{19}^{40}K$与${\;}_{20}^{40}Ca$,K和Na是不同元素,所以不是同位素,故A错误;
B.D2O与T2O是化合物不是元素,所以不是同位素,是同一种物质,故B错误;
C.${\;}_{19}^{40}K$与${\;}_{19}^{39}K$的质子数都是19,.${\;}_{19}^{40}K$的中子数是40-19=21,${\;}_{19}^{39}K$的中子数是39-19=20,所以${\;}_{19}^{40}K$与${\;}_{19}^{39}K$是同位素,故C正确;
D.白磷与红磷是磷元素的不同单质,属于同素异形体,故D错误.
故选C.
点评 本题考查了同位素的判断,明确原子中不同位置数字的意义及同位素和同素异形体的区别即可解答,题目较简单.

练习册系列答案
相关题目
18.下列说法中错误的是( )
| A. | SO2、SO3都是极性分子 | |
| B. | 在NH4+ 和[Cu(NH3)4]2+中都存在配位键 | |
| C. | 元素电负性越大的原子,吸引电子的能力越强 | |
| D. | 非金属元素原子之间也可能形成离子化合物 |
16.有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)A原子的核外电子排布式为1s22s22p63s1.
(2)B元素在周期表中的位置为第3周期ⅢA族;离子半径:B小于A(填“大于”或“小于”).
(3)C原子的电子排布图是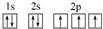 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
(4)D原子的电子排布式为1s22s22p63s23p5或[Ne]3s23p5,D-的结构示意图是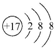 .
.
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式为1s22s22p63s1.
(2)B元素在周期表中的位置为第3周期ⅢA族;离子半径:B小于A(填“大于”或“小于”).
(3)C原子的电子排布图是
 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.(4)D原子的电子排布式为1s22s22p63s23p5或[Ne]3s23p5,D-的结构示意图是
 .
.
13.非金属性最强的元素是( )
| A. | F | B. | C | C. | S | D. | O |
17. 如图表示4个碳原子相互结合的几种方式.小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是( )
如图表示4个碳原子相互结合的几种方式.小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是( )
 如图表示4个碳原子相互结合的几种方式.小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是( )
如图表示4个碳原子相互结合的几种方式.小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是( )| A. | 图中属于烷烃的是A、C、H | |
| B. | 图中C和F分子中氢原子数相同 | |
| C. | 图中物质碳元素的质量分数最大的是C | |
| D. | 图中与B互为同分异构体的有E、F、H |
18.下列分析及判断中正确的是( )
| A. | 常温下0.1mol•L-1醋酸溶液pH=a,将溶液稀释到原体积的10倍pH=a+1 | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012溶液中:NH4+、Al3+、NO3-、Cl-可以大量共存 | |
| C. | CO2分子中,碳氧键为极性键,正电荷中心和负电荷中心不重合,为极性分子 | |
| D. | pH=8.0的溶液中,CO2的主要存在形态为CO32- |

 .
.