题目内容
16.有四种短周期元素,它们的结构、性质等信息如下表所述:| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式为1s22s22p63s1.
(2)B元素在周期表中的位置为第3周期ⅢA族;离子半径:B小于A(填“大于”或“小于”).
(3)C原子的电子排布图是
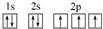 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈哑铃形.(4)D原子的电子排布式为1s22s22p63s23p5或[Ne]3s23p5,D-的结构示意图是
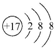 .
.
分析 A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,则A为Na;B与A同周期,即处于第三周期,B的最高价氧化物的水化物呈两性,故B为Al;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自水生产过程中常用的消毒杀菌剂,则D为Cl.
解答 解:A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,则A为Na;B与A同周期,即处于第三周期,B的最高价氧化物的水化物呈两性,故B为Al;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自水生产过程中常用的消毒杀菌剂,则D为Cl,
(1)A为Na,原子核外电子数为11,原子的核外电子排布式为:1s22s22p63s1,
故答案为:1s22s22p63s1;
(2)B为Al,元素在周期表中的位置是:第3周期第ⅢA族,钠离子、铝离子核外电子层结构相同,核电荷数越大离子半径越小,故铝离子半径小于钠离子比较,
故答案为:第3周期ⅢA族;小于;
(3)C为N元素,核外电子排布式为:1s22s22p3,原子的电子排布图是 ,其原子核外2p轨道有3个未成对电子,p轨道的电子能量最高,轨道呈哑铃形,
,其原子核外2p轨道有3个未成对电子,p轨道的电子能量最高,轨道呈哑铃形,
故答案为: ;3;p;哑铃;
;3;p;哑铃;
(4)D为Cl元素,原子的核外电子排布式为1s22s22p63s23p5或[Ne]3s23p5,Cl-的结构示意图是: ,故答案为:1s22s22p63s23p5或[Ne]3s23p5;
,故答案为:1s22s22p63s23p5或[Ne]3s23p5; .
.
点评 本题考查结构性质位置关系应用,侧重对核外电子排布规律的考查,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.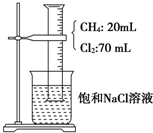 如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的烧杯中进行实验,对实验现象及产物分析中错误的是( )
如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的烧杯中进行实验,对实验现象及产物分析中错误的是( )
 如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的烧杯中进行实验,对实验现象及产物分析中错误的是( )
如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的烧杯中进行实验,对实验现象及产物分析中错误的是( )| A. | 混合气体的颜色变浅,量筒中液面上升 | |
| B. | 量筒内壁上出现的油状液滴,应是三氯甲烷、四氯甲烷的混合物 | |
| C. | 烧杯中有白色固体物质析出 | |
| D. | 甲烷与氯气反应后的产物只有CCl4 |
7.能贮存在具有玻璃塞的磨口试剂瓶里的试剂是( )
| A. | HF溶液 | B. | KOH溶液 | C. | 盐酸 | D. | 水玻璃 |
11.下列表述正确的是( )
| A. | H、D、T互为同素异形体 | B. | 中子数为20的氯原子: | ||
| C. | 四氯化碳的电子式: | D. | Cl-的结构示意图: |
1.下列分子式只能表示一种物质的是( )
| A. | C2H4 Br2 | B. | C3H8 | C. | C4H9Cl | D. | C |
8.下列各组中属于同位素关系的是( )
| A. | ${\;}_{19}^{40}K$与${\;}_{20}^{40}Ca$ | B. | D2O与T2O | ||
| C. | ${\;}_{19}^{40}K$与${\;}_{19}^{39}K$ | D. | 白磷与红磷 |
5.食盐(NaCl)是生活中常用的调味品,HCl是胃酸的主要成分,下列关于两种物质的说法正确的是( )
| A. | 炒菜时放入食盐并不破坏NaCl中的化学键 | |
| B. | HCl的电子式是H+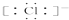 | |
| C. | HCl的结构式是H-Cl | |
| D. | NaCl熔化时破坏共价键 |
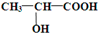
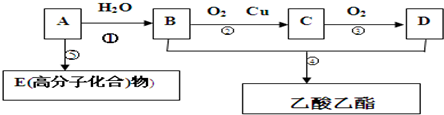
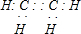
 CH3COOC2H5+H2O
CH3COOC2H5+H2O