题目内容
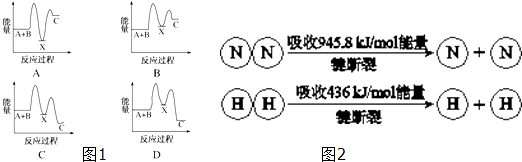
3.(1)反应A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热).下列示意图1中,能正确表示总反应过程中能量变化的是D(2)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.已知(见图2):则1mol N-H键断裂吸收的能量约等于391kJ.
分析 (1)根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热;
(2)3H2+N2?2NH3,依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算得到.
解答 解:(1)A+B→C为放热反应,则A+B的总能量大于生成C的总能量,排除选项A、B,A+B→X(吸热),则X的能量大于A+B的总能量,X→C(放热),则X的能量大于C的总能量,排除选项C,
故选D;
(2)工业合成氨反应为:3H2+N2?2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=+391kJ,
故答案为:391.
点评 本题为图象题,主要考查了物质的能量分析应用,化学反应的能量变化、分析,题目难度不大,注意反应热与物质总能量大小的关系判断.

练习册系列答案
相关题目
13.下列物质中不属于有机物的是的是( )
| A. | C2H2 | B. | CH3COOH | C. | SiC | D. | HCHO |
11.下列表述正确的是( )
| A. | H、D、T互为同素异形体 | B. | 中子数为20的氯原子: | ||
| C. | 四氯化碳的电子式: | D. | Cl-的结构示意图: |
18.C3H8分子中的共价键总数为( )
| A. | 10 | B. | 12 | C. | 8 | D. | 11 |
8.下列各组中属于同位素关系的是( )
| A. | ${\;}_{19}^{40}K$与${\;}_{20}^{40}Ca$ | B. | D2O与T2O | ||
| C. | ${\;}_{19}^{40}K$与${\;}_{19}^{39}K$ | D. | 白磷与红磷 |
15.下列说法不正确的是( )
| A. | 因为甲醇分子中不含有碳碳双键,所以甲醇不能使酸性高锰酸钾溶液褪色 | |
| B. | 甲苯不使溴水褪色,但甲苯和溴可以发生取代反应 | |
| C. | 乙烯在一定条件下与氧气反应生成乙醛,乙烯发生了氧化反应 | |
| D. | 蛋氨酸分子中含有羧基(-COOH)和氨基(-NH2) |

 .在多种生物化学过程中乳酸起重要作用,在一般的新陈代谢和运动中乳酸不断被产生.请回答下列问题:
.在多种生物化学过程中乳酸起重要作用,在一般的新陈代谢和运动中乳酸不断被产生.请回答下列问题: