题目内容
20.为减少铬渣的危害并从中提取硫酸钠,设计工艺如图1: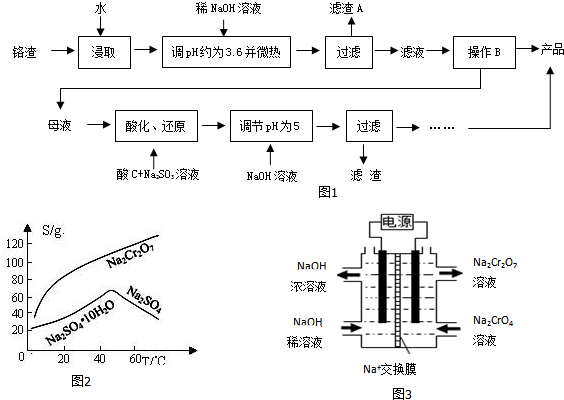
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+
②Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol•L-1)时pH分别为3.6和5.
(1)“微热”的作用:①提高反应速率;②促进Fe3+水解生成Fe(OH)3而除去.
(2)根据溶解度(S)~温度(T)曲线,操作B的最佳方法为a(填字母)
a.蒸发浓缩,趁热过滤 b.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;酸C为H2SO4,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=1.0×10-32mol4•L-4.
(4)已知Cr(OH)3在溶液中存在平衡H++CrO2-(亮绿色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-,加入NaOH溶液时要控制pH为5,pH不能过高的理由是加入NaOH使上述平衡逆移,使Cr(OH)3+OH-=CrO2-+2H2O.
(5)根据2CrO42-+2H+?Cr2O72-+H2O设计如图2装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图3中左侧电极连接电源的负极,电解制备过程的总反应方程式为4Na2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2Na2Cr2O7+4NaOH+2H2↑+O2↑.测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为d,则此时Na2CrO4的转化率为(2-d)×100%.若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为CH3OH-6e-+3CO32-=4CO2+2H2O.
分析 铬渣含有Na2SO4及少量Cr2O72-、Fe3+,加入氢氧化钠调节pH约3.6并加热,可生成Fe(OH)3沉淀,过滤得到A为Fe(OH)3,由于Na2Cr2O7溶解度在温度较高时较大,滤液经蒸发浓缩,趁热过滤得到硫酸钠,母液中含有Na2Cr2O7,加入亚硫酸钠,发生氧化还原反应可得到Cr3+,调节溶液pH为5,可生成沉淀D,即Cr(OH)3,以此解答该题.
解答 解:铬渣含有Na2SO4及少量Cr2O72-、Fe3+,加入氢氧化钠调节pH约3.6并加热,可生成Fe(OH)3沉淀,过滤得到A为Fe(OH)3,由于Na2Cr2O7溶解度在温度较高时较大,滤液经蒸发浓缩,趁热过滤得到硫酸钠,母液中含有Na2Cr2O7,加入亚硫酸钠,发生氧化还原反应可得到Cr3+,调节溶液pH为5,可生成沉淀D,即Cr(OH)3,
(1)加热可以提高反应速率,且有利于Fe3+水解生成Fe(OH)3而除去,
故答案为:提高反应速率;促进Fe3+水解生成Fe(OH)3而除去;
(2)由于Na2Cr2O7溶解度在温度较高时较大,滤液经蒸发浓缩,趁热过滤得到硫酸钠,故答案为:a;
(3)酸化后的Cr2O72-可被SO32-还原成Cr3+,离子方程式为3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O,Na2Cr2O7具有强氧化性,酸化时,一般用稀硫酸,Cr3+完全沉淀(c≤1.0×10-5 mol•L-1)时pH5,则c(OH-)=1.0×10-9 mol•L-1,Ksp[Cr(OH)3]=c3(OH-)×c(Cr3+)=1.0×10-32 mol4•L-4,
故答案为:3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;H2SO4; 1.0×10-32 mol4•L-4;
(4)如果氢氧化钠过量,氢离子浓度减少平衡H++CrO2-(亮绿色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-,平衡逆向移动,Cr(OH)3会溶解,
故答案为:加入NaOH使上述平衡逆移,使Cr(OH)3+OH-=CrO2-+2H2O;
(5)根据2CrO42-+2H+=Cr2O72-+H2O电解Na2CrO4溶液制取Na2Cr2O7,应在酸性条件下进行,即右侧电极生成H+,则消耗OH-,发生氧化反应,右侧为阳极,则左侧为阴极,连接电源的负极,电解制备过程的总反应方程式为 4Na2CrO4+4H2O $\frac{\underline{\;通电\;}}{\;}$ 2Na2Cr2O7+4NaOH+2H2↑+O2↑,设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7为$\frac{x}{2}$mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,解得x=2-d,转化率为$\frac{2-d}{1}$×100%=(2-d)×100%,
若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为CH3OH-6e-+3CO32-=4CO2+2H2O,
故答案为:负; 4Na2CrO4+4H2O $\frac{\underline{\;通电\;}}{\;}$ 2Na2Cr2O7+4NaOH+2H2↑+O2↑;(2-d)×100%;CH3OH-6e-+3CO32-=4CO2+2H2O.
点评 本题考查物质的分离、提纯的实验设计,为高考常见题型,侧重于学生的分析能力和实验能力的考查,题目以实验形式考查电解原理及难溶电解质的溶解平衡和沉淀转化,注意信息与所学知识的结合来解答,并注意氧化还原反应及图表数据的应用,题目难度中等.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案| A. | 1H与2H | B. | O2与O3 | C. | 乙烯与丙烯 | D. | 正丁烷与异丁烷 |
| A. | H、D、T互为同素异形体 | B. | 中子数为20的氯原子: | ||
| C. | 四氯化碳的电子式: | D. | Cl-的结构示意图: |
| A. | ${\;}_{19}^{40}K$与${\;}_{20}^{40}Ca$ | B. | D2O与T2O | ||
| C. | ${\;}_{19}^{40}K$与${\;}_{19}^{39}K$ | D. | 白磷与红磷 |
| A. | 因为甲醇分子中不含有碳碳双键,所以甲醇不能使酸性高锰酸钾溶液褪色 | |
| B. | 甲苯不使溴水褪色,但甲苯和溴可以发生取代反应 | |
| C. | 乙烯在一定条件下与氧气反应生成乙醛,乙烯发生了氧化反应 | |
| D. | 蛋氨酸分子中含有羧基(-COOH)和氨基(-NH2) |
| A. | 炒菜时放入食盐并不破坏NaCl中的化学键 | |
| B. | HCl的电子式是H+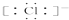 | |
| C. | HCl的结构式是H-Cl | |
| D. | NaCl熔化时破坏共价键 |
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 蛋白质遇重金属离子会变性 | |
| C. | α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽 | |
| D. | 食用油反复加热会产生稠环芳香烃等有害物质 |