题目内容
光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:据此,下列判断中正确的是( )
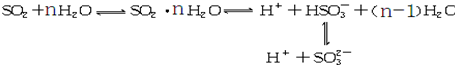
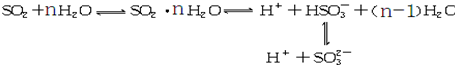
| A、该溶液中所含微粒种类至少6种 |
| B、向该溶液中加入少量BaCl2固体,上述平衡向正向移动 |
| C、向该溶液中加入足量的酸都能放出SO2气体 |
| D、该溶液中:C(H+)>C(HSO3-)>C(SO32-) |
考点:化学平衡的影响因素
专题:
分析:根据可逆反应在转化中存在不完全转化性,反应物与生成物都存在同一体系中,并利用离子浓度的改变来分析平衡的移动.
解答:
解:A、该溶液中所含微粒有二氧化硫分子、水分子、氢离子、氢氧根离子、亚硫酸根离子、亚硫酸氢根离子、水和二氧化硫分子8种微粒,故A正确;
B、BaCl2与亚硫酸根离子不反应,故B错误
C、SO2是一种还原性气体,若加入的酸是氧化性酸,SO2将被氧化成硫酸而不会放出SO2气体,当加入非氧化性酸,平衡逆向移动,有气体放出,故C错误;
D、据上述方程式分析,亚硫酸氢根离子浓度大于亚硫酸根离子,故D正确;
故选AD.
B、BaCl2与亚硫酸根离子不反应,故B错误
C、SO2是一种还原性气体,若加入的酸是氧化性酸,SO2将被氧化成硫酸而不会放出SO2气体,当加入非氧化性酸,平衡逆向移动,有气体放出,故C错误;
D、据上述方程式分析,亚硫酸氢根离子浓度大于亚硫酸根离子,故D正确;
故选AD.
点评:本题通过给予一些信息,依据平衡理论,解答相关问题,考查学生的学习能力.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
下列各反应达到化学平衡后,加压能使化学平衡向逆反应方向移动的是( )
| A、2NO2?N2O4 |
| B、C(s)+CO2?2CO |
| C、N2+3H2?2NH3 |
| D、H2S?H2+S(s) |
 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强,或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,则对该反应叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强,或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,则对该反应叙述正确的是( )| A、正反应是放热反应,m+n>p+q |
| B、逆反应是放热反应,m+n>p+q |
| C、正反应是放热反应,m+n<p+q |
| D、逆反应是放热反应,m+n<p+q |
下列各项比较中前者高于(或大于或强于)后者的是( )
| A、金属Mg和金属Cu的空间利用率 |
| B、C-O和Si-O的键能 |
| C、H2SO3和H2SO4中心原子的价层电子对数 |
D、邻羟基苯甲醛(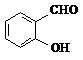 )和对羟基苯甲醛( )和对羟基苯甲醛(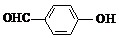 )的沸点 )的沸点 |
下列对某些离子的检验及结论一定正确的是( )
| A、加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定有SO42- |
| B、加入碳酸钠溶液有白色沉淀生成,再加盐酸,沉淀消失,则原溶液中一定有Ba2+ |
| C、通入Cl2后,溶液变为黄色,加入淀粉后溶液变蓝,则原溶液中一定有I- |
| D、加入NaOH溶液并加热,产生使湿润蓝色石蕊试纸变红的气体,则原溶液一定有NH4+ |