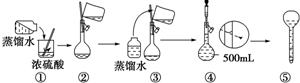
题目内容
下列各反应达到化学平衡后,加压能使化学平衡向逆反应方向移动的是( )
| A、2NO2?N2O4 |
| B、C(s)+CO2?2CO |
| C、N2+3H2?2NH3 |
| D、H2S?H2+S(s) |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:根据化学平衡移动原理:增大压强,化学平衡向着气体体积减小的方向进行;升高温度,化学平衡向着吸热方向进行,据此结合选项解答.
解答:
解:A.正反应为体积减小的反应,增大压强,平衡正向移动,故A不选;
B.正反应为体积增大的反应,增大压强,平衡逆向移动,故B选;
C.正反应为体积减小的反应,增大压强,平衡正向移动,故C不选;
D.反应前后体积不变,增大压强平衡不移动,故D不选;
故选B.
B.正反应为体积增大的反应,增大压强,平衡逆向移动,故B选;
C.正反应为体积减小的反应,增大压强,平衡正向移动,故C不选;
D.反应前后体积不变,增大压强平衡不移动,故D不选;
故选B.
点评:本题考查温度和压强对化学平衡移动的影响,注意根据反应特征利用平衡移动原理解答,难度不大.

练习册系列答案
相关题目
能将NH4NO3、Na2SO4、KCl、(NH4)2SO4四种溶液一步加以区别(可以加热)的试剂为( )
| A、BaCl2 |
| B、Ba(NO3)2 |
| C、Ba(OH)2 |
| D、AgNO3 |
下表中与化学反应相对应的方程式中,正确的是( )
A、化学反应:以石墨作电极电解氯化钠溶液,离子方程式:2Cl-+2H2O
| ||||
| B、化学反应:以银作电极电解硝酸银溶液,离子方程式4Ag++2H2O=4Ag+O2↑+4H+ | ||||
| C、化学反应:铅蓄电池正极反应,离子方程式:PbO2+4H++2e-═Pb2++2H2O | ||||
| D、化学反应:氢氧燃料电池(KOH做电解液)负极反应,离子方程式:O2+4e-+2H2O=4OH- |
现有一瓶甲、乙的混合物,已知它们的性质如下表,据此,将甲、乙互相分离的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 甲 | -11.5℃ | 198℃ | 1.11 g?mL-1 | A、B互溶且均易溶于水 |
| 乙 | -17.9℃ | 290℃ | 1.26 g?mL-1 |
| A、萃取法 | B、蒸馏法 |
| C、分液法 | D、结晶法 |
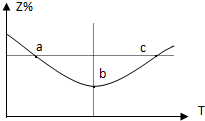 在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )
在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )| A、升高温度,平衡常数减小 |
| B、Z在a、c两点的反应速率相等 |
| C、b点时,Z的转化率最小 |
| D、平衡时充入惰性气体时,平衡向逆反应方向移动 |
光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:据此,下列判断中正确的是( )
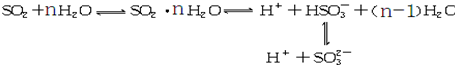
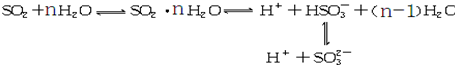
| A、该溶液中所含微粒种类至少6种 |
| B、向该溶液中加入少量BaCl2固体,上述平衡向正向移动 |
| C、向该溶液中加入足量的酸都能放出SO2气体 |
| D、该溶液中:C(H+)>C(HSO3-)>C(SO32-) |
部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( )


| A、V=224 |
| B、样品中Fe的质量为2.14g |
| C、样品中CuO的质量为3.52g |
| D、未氧化前Fe元素的质量分数约为41.2% |