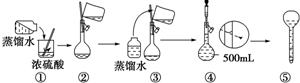
题目内容
下列各项比较中前者高于(或大于或强于)后者的是( )
| A、金属Mg和金属Cu的空间利用率 |
| B、C-O和Si-O的键能 |
| C、H2SO3和H2SO4中心原子的价层电子对数 |
D、邻羟基苯甲醛(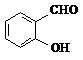 )和对羟基苯甲醛( )和对羟基苯甲醛(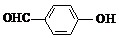 )的沸点 )的沸点 |
考点:不同晶体的结构微粒及微粒间作用力的区别,原子核外电子排布,键能、键长、键角及其应用,晶体的类型与物质熔点、硬度、导电性等的关系
专题:
分析:A.金属Mg属于六方最密堆积,金属Cu属于面心立方最密堆积;
B.原子半径越小,共价键键能越大;
C.根据价层电子对互斥理论确定分子的中心原子的价层电子对数;
D.分子内形成氢键,使熔沸点降低,分子间氢键,使熔沸点升高;
B.原子半径越小,共价键键能越大;
C.根据价层电子对互斥理论确定分子的中心原子的价层电子对数;
D.分子内形成氢键,使熔沸点降低,分子间氢键,使熔沸点升高;
解答:
解:A.金属Mg属于六方最密堆积,金属Cu属于面心立方最密堆积,二者的空间利用率相同均为74%,故A错误;
B.原子半径越小,共价键键能越大,原子半径:C<Si,则C-O和Si-O的键能前者高,故B正确;
C.H2SO3中S的价层电子对个数=3+
(6+2-2×3)=4,H2SO4中S的价层电子对个数=4+
(6+2-2×4)=4,二者相同,故C错误;
D.邻羟基苯甲醛的两个基团靠的很近,能形成分子内氢键,使熔沸点降低;而对羟基苯甲醛能够形成分子间氢键,使熔沸点升高,所以邻羟基苯甲醛比对羟基苯甲醛熔、沸点低,故D错误;
故选B.
B.原子半径越小,共价键键能越大,原子半径:C<Si,则C-O和Si-O的键能前者高,故B正确;
C.H2SO3中S的价层电子对个数=3+
| 1 |
| 2 |
| 1 |
| 2 |
D.邻羟基苯甲醛的两个基团靠的很近,能形成分子内氢键,使熔沸点降低;而对羟基苯甲醛能够形成分子间氢键,使熔沸点升高,所以邻羟基苯甲醛比对羟基苯甲醛熔、沸点低,故D错误;
故选B.
点评:本题考查较为综合,涉及金属晶体的堆积方式、键能比较、价层电子对数的判断、沸点比较等知识,题目难度中等,注意把握比较的方法和角度,注意注意氢键对熔沸点的影响.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
现有一瓶甲、乙的混合物,已知它们的性质如下表,据此,将甲、乙互相分离的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 甲 | -11.5℃ | 198℃ | 1.11 g?mL-1 | A、B互溶且均易溶于水 |
| 乙 | -17.9℃ | 290℃ | 1.26 g?mL-1 |
| A、萃取法 | B、蒸馏法 |
| C、分液法 | D、结晶法 |
光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:据此,下列判断中正确的是( )
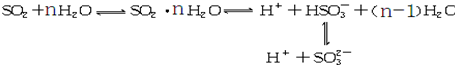
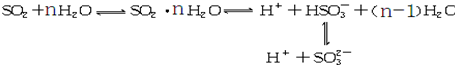
| A、该溶液中所含微粒种类至少6种 |
| B、向该溶液中加入少量BaCl2固体,上述平衡向正向移动 |
| C、向该溶液中加入足量的酸都能放出SO2气体 |
| D、该溶液中:C(H+)>C(HSO3-)>C(SO32-) |
晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如图所示,下列说法正确的是( )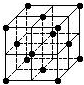

| A、C60属于离子晶体 |
| B、C60摩尔质量是720 |
| C、在C60晶胞中平均每个晶胞有14个C60分子 |
| D、每个C60分子周围与它距离最近等距离的C60分子有12个 |
金属铝与盐酸反应,下列叙述不正确的是( )
| A、铝作还原剂,氢气做氧化产物 |
| B、该反应属于典型的放热反应 |
| C、如果把该反应设计成原电池,铁、锌均可以做正极 |
| D、标况下,转移2mol 电子,就生成22.4L的氢气 |
下列叙述正确的是( )
| A、氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
| B、含有最低价元素的化合物不一定具有很强的还原性 |
| C、阳离子只能得电子被还原,阴离子只能失电子被氧化 |
| D、在化学反应中,得电子越多的氧化剂,其氧化性就越强 |