题目内容
医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为:
已知:查阅资料得知氢氧化物沉淀时的pH为:
(1)CaCO3与盐酸反应的离子方程式 .
(2)除杂操作是加入氢氧化钙,调节溶液的pH为 ,目的是除去溶液中少量的Al3+、Fe3+.检验Fe(OH)3是否沉淀完全的实验操作是 .
(3)过滤时需用的玻璃仪器有 .滤渣主要成分的化学式 .
(4)酸化时加盐酸的目的为:① ,②防止Ca2+在蒸发时发生水解.
(5)为什么蒸发结晶要保持在160℃: .
(6)若所测样品 CaCl2?2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为 .
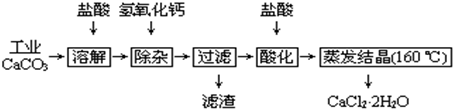
已知:查阅资料得知氢氧化物沉淀时的pH为:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
(2)除杂操作是加入氢氧化钙,调节溶液的pH为
(3)过滤时需用的玻璃仪器有
(4)酸化时加盐酸的目的为:①
(5)为什么蒸发结晶要保持在160℃:
(6)若所测样品 CaCl2?2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为

考点:物质分离和提纯的方法和基本操作综合应用
专题:
分析:工业碳酸钙加入盐酸可完全溶解生成氯化钙、氯化铁以及氯化铝等,加入氢氧化钙溶液调节溶液的pH为8.0~8.5,以除去溶液中少量的Al3+、Fe3+,然后在酸性条件下蒸发结晶可得到CaCl2?2H2O,
(1)碳酸钙可以和盐酸发生反应生成氯化钙、水以及二氧化碳;
(2)根据铁离子完全沉淀、铝离子完全沉淀、氢氧化铝开始溶解的pH判断需要体积的pH范围;Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液;
(3)加入氢氧化钙生成氢氧化铝、氢氧化铁沉淀,过滤需要烧杯、玻璃棒和普通漏斗;
(4)加入过量盐酸,可中和氢氧化钙以及防止Ca2+在蒸发时发生水解;
(5)从溶液中得到晶体,加热温度不能过高,防止晶体分解;
(6)样品中存在少量的NaCl,根据 n(AgCl)2n(CaCl2.2H2O)可知,CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大.
(1)碳酸钙可以和盐酸发生反应生成氯化钙、水以及二氧化碳;
(2)根据铁离子完全沉淀、铝离子完全沉淀、氢氧化铝开始溶解的pH判断需要体积的pH范围;Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液;
(3)加入氢氧化钙生成氢氧化铝、氢氧化铁沉淀,过滤需要烧杯、玻璃棒和普通漏斗;
(4)加入过量盐酸,可中和氢氧化钙以及防止Ca2+在蒸发时发生水解;
(5)从溶液中得到晶体,加热温度不能过高,防止晶体分解;
(6)样品中存在少量的NaCl,根据 n(AgCl)2n(CaCl2.2H2O)可知,CaCl2.2H2O的物质的量增大.同样若CaCl2.2H2O失水导致分母变小,值偏大.
解答:
解:(1)碳酸钙可以和盐酸发生反应生成氯化钙、水以及二氧化碳,反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;
(2)根据表中数据可知,氢氧化铁完全沉淀的pH为3.7,氢氧化铝开始沉淀的pH为5.2,氢氧化铝开始溶解的pH为7.8,所以将铁离子、铝离子完全转化成沉淀的pH范围为:5.2~7.8;
Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液,操作为取少量上层清液于小试管中,滴加KSCN溶液,若不显红色,则Fe(OH)3沉淀完全,
故答案为:5.2~7.8(或之间的任意值);取少量上层清液于小试管中,滴加KSCN溶液,若不显红色,则Fe(OH)3沉淀完全;
(3)过滤时需用的玻璃仪器有烧杯、玻璃棒和普通漏斗;加入氢氧化钙生成氢氧化铝、氢氧化铁沉淀,所以滤渣的主要成分为:Fe(OH)3、Al(OH)3,
故答案为:烧杯、玻璃棒、普通漏斗;Fe(OH)3、Al(OH)3;
(4)因除去铁离子、铝离子需加入过量的氢氧化钙,加入盐酸,可中和氢氧化钙以及防止Ca2+在蒸发时发生水解,
故答案为:除去过量的氢氧化钙;
(5)从溶液中得到晶体,加热温度不能过高,防止因温度太高CaCl2?2H2O会失水,
故答案为:温度太高CaCl2?2H2O会失水;
(6)品中存在少量的NaCl,对氯化钙晶体加热使之失去结晶水操作中,干燥温度过高时CaCl2?2H2O 晶体失去部分结晶水,会给实验带来误差,
故答案为:样品中存在少量的NaCl或干燥温度过高时CaCl2?2H2O晶体失去部分结晶水.
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;
(2)根据表中数据可知,氢氧化铁完全沉淀的pH为3.7,氢氧化铝开始沉淀的pH为5.2,氢氧化铝开始溶解的pH为7.8,所以将铁离子、铝离子完全转化成沉淀的pH范围为:5.2~7.8;
Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液,操作为取少量上层清液于小试管中,滴加KSCN溶液,若不显红色,则Fe(OH)3沉淀完全,
故答案为:5.2~7.8(或之间的任意值);取少量上层清液于小试管中,滴加KSCN溶液,若不显红色,则Fe(OH)3沉淀完全;
(3)过滤时需用的玻璃仪器有烧杯、玻璃棒和普通漏斗;加入氢氧化钙生成氢氧化铝、氢氧化铁沉淀,所以滤渣的主要成分为:Fe(OH)3、Al(OH)3,
故答案为:烧杯、玻璃棒、普通漏斗;Fe(OH)3、Al(OH)3;
(4)因除去铁离子、铝离子需加入过量的氢氧化钙,加入盐酸,可中和氢氧化钙以及防止Ca2+在蒸发时发生水解,
故答案为:除去过量的氢氧化钙;
(5)从溶液中得到晶体,加热温度不能过高,防止因温度太高CaCl2?2H2O会失水,
故答案为:温度太高CaCl2?2H2O会失水;
(6)品中存在少量的NaCl,对氯化钙晶体加热使之失去结晶水操作中,干燥温度过高时CaCl2?2H2O 晶体失去部分结晶水,会给实验带来误差,
故答案为:样品中存在少量的NaCl或干燥温度过高时CaCl2?2H2O晶体失去部分结晶水.
点评:本题主要考查实验的基本操作、实验仪器的选择、实验误差分析等知识,为高频考点,侧重于学生的分析、实验和计算能力的考查,注意离子的检验方法和常见仪器的使用,样品纯度的分析要注意溶液中可能发生的反应,难度中等.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
能将NH4NO3、Na2SO4、KCl、(NH4)2SO4四种溶液一步加以区别(可以加热)的试剂为( )
| A、BaCl2 |
| B、Ba(NO3)2 |
| C、Ba(OH)2 |
| D、AgNO3 |
下列说法不正确的是( )
| A、易溶于水的固体物质与水用蒸馏的方法分离 |
| B、互溶的液体用蒸馏的方法分离 |
| C、互不相容的两种液体用分液的方法分离 |
| D、难溶于水的物质与水用过滤的方法分离 |
下表中与化学反应相对应的方程式中,正确的是( )
A、化学反应:以石墨作电极电解氯化钠溶液,离子方程式:2Cl-+2H2O
| ||||
| B、化学反应:以银作电极电解硝酸银溶液,离子方程式4Ag++2H2O=4Ag+O2↑+4H+ | ||||
| C、化学反应:铅蓄电池正极反应,离子方程式:PbO2+4H++2e-═Pb2++2H2O | ||||
| D、化学反应:氢氧燃料电池(KOH做电解液)负极反应,离子方程式:O2+4e-+2H2O=4OH- |
现有一瓶甲、乙的混合物,已知它们的性质如下表,据此,将甲、乙互相分离的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 甲 | -11.5℃ | 198℃ | 1.11 g?mL-1 | A、B互溶且均易溶于水 |
| 乙 | -17.9℃ | 290℃ | 1.26 g?mL-1 |
| A、萃取法 | B、蒸馏法 |
| C、分液法 | D、结晶法 |
光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:据此,下列判断中正确的是( )
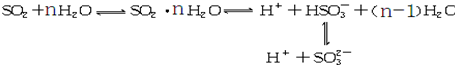
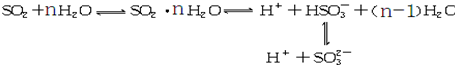
| A、该溶液中所含微粒种类至少6种 |
| B、向该溶液中加入少量BaCl2固体,上述平衡向正向移动 |
| C、向该溶液中加入足量的酸都能放出SO2气体 |
| D、该溶液中:C(H+)>C(HSO3-)>C(SO32-) |
金属铝与盐酸反应,下列叙述不正确的是( )
| A、铝作还原剂,氢气做氧化产物 |
| B、该反应属于典型的放热反应 |
| C、如果把该反应设计成原电池,铁、锌均可以做正极 |
| D、标况下,转移2mol 电子,就生成22.4L的氢气 |
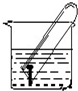 电化学在工业生产中有广泛应用.如图所示,水槽中试管内有一枚铁钉,放置数天观察,发现铁钉被腐蚀.
电化学在工业生产中有广泛应用.如图所示,水槽中试管内有一枚铁钉,放置数天观察,发现铁钉被腐蚀.