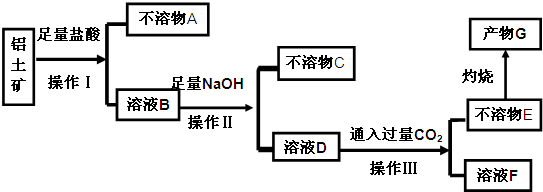
题目内容
某研究性学习小组利用废旧铅蓄电池阴、阳极填充物------铅膏(含PbO、PbO2、PbSO4)制备电绝缘材料三盐基硫酸铅(3PbO?PbSO4?H2O),进行资源回收研究,设计实验流程如下:
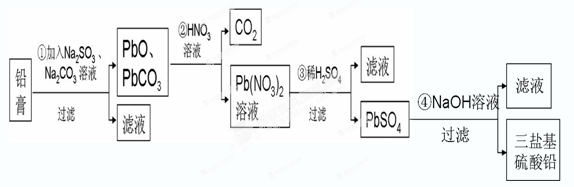
(1)步骤①铅膏中PbSO4与Na2CO3溶液反应转化为PbCO3,说明溶解度:PbSO4 (填“>”或“<”)PbCO3.
(2)步骤①中PbO2转化为PbCO3的离子方程式是(请配平此离子方程式):PbO2+SO32-+CO32-+ ═PbCO3↓+SO42-+OH-.
(3)将步骤①和④的滤液合并,加入 PH=7,再经过 、冷却结晶、 、洗涤、干燥,可获得Na2SO4?10H2O晶体.
(4)若铅膏的质量为78g,步骤①中PbO2和PbSO4全部转化为PbCO3,且PbO未发生反应;步骤②中共收集到5.6LCO2(标准状态),步骤③中获得90.9g PbSO4,则铅膏中PbO的质量分数为 (假设流程中原料无损失).

(1)步骤①铅膏中PbSO4与Na2CO3溶液反应转化为PbCO3,说明溶解度:PbSO4
(2)步骤①中PbO2转化为PbCO3的离子方程式是(请配平此离子方程式):PbO2+SO32-+CO32-+
(3)将步骤①和④的滤液合并,加入
(4)若铅膏的质量为78g,步骤①中PbO2和PbSO4全部转化为PbCO3,且PbO未发生反应;步骤②中共收集到5.6LCO2(标准状态),步骤③中获得90.9g PbSO4,则铅膏中PbO的质量分数为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:铅膏(含PbO、PbO2、PbSO4)中加入亚硫酸钠和碳酸钠之后,铅膏中PbSO4与Na2CO3溶液反应转化为PbCO3和硫酸钠溶液,PbO2转化为PbCO3,其中的PbO和碳酸铅被过滤出来,向其中加入硝酸,可以得到硝酸铅溶液,同时放出二氧化碳气体,向硝酸铅中加入硫酸,发生复分解反应得到硫酸铅和硝酸,向酸性的硫酸铅溶液中加入过量的氢氧化钠溶液过滤可以得到三盐基硫酸铅(3PbO?PbSO4?H2O)和硫酸钠的溶液,硫酸钠溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥可以得到硫酸钠的晶体.
(1)沉淀是向着更难溶的方向转化;
(2)根据氧化还原反应中化合价的升降结合电子守恒、电荷守恒以及元素守恒来计算;
(3)硫酸钠溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥可以得到硫酸钠的晶体;
(4)根据C元素守恒计算碳酸铅的物质的量,根据Pb元素守恒,计算PbO和碳酸铅的物质的量,据此计算PbO的物质的量,进而计算其质量分数.
(1)沉淀是向着更难溶的方向转化;
(2)根据氧化还原反应中化合价的升降结合电子守恒、电荷守恒以及元素守恒来计算;
(3)硫酸钠溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥可以得到硫酸钠的晶体;
(4)根据C元素守恒计算碳酸铅的物质的量,根据Pb元素守恒,计算PbO和碳酸铅的物质的量,据此计算PbO的物质的量,进而计算其质量分数.
解答:
解:铅膏(含PbO、PbO2、PbSO4)中加入亚硫酸钠和碳酸钠之后,铅膏中PbSO4与Na2CO3溶液反应转化为PbCO3和硫酸钠溶液,PbO2转化为PbCO3,其中的PbO和碳酸铅被过滤出来,向其中加入硝酸,可以得到硝酸铅溶液,同时放出二氧化碳气体,向硝酸铅中加入硫酸,发生复分解反应得到硫酸铅和硝酸,向酸性的硫酸铅溶液中加入过量的氢氧化钠溶液过滤可以得到三盐基硫酸铅(3PbO?PbSO4?H2O)和硫酸钠的溶液,硫酸钠溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥可以得到硫酸钠的晶体.
(1)铅膏中PbSO4与Na2CO3溶液反应转化为PbCO3和硫酸钠溶液,PbSO4转化为PbCO3,说明溶解度:PbSO4的要大于碳酸铅的,沉淀是向着更难溶的方向转化;
故答案为:>;
(2)反应PbO2+SO32-+CO32-+?→PbCO3↓+SO42-+OH-中,Pb的化合价降低了2价,S的化合价升高了2价,所以PbO2、SO32-、PbCO3、SO42-的系数都是1,根据碳元素守恒,CO32-,的系数是1,根据电荷守恒,OH-的系数是2,根据H元素守恒,反应物中应该添加H2O,即PbO2+SO32-+CO32-+H2O=PbCO3↓+SO42-+2OH-,
故答案为:1,1,1,1,H2O,1,1,2;
(3)将步骤①和④的滤液即硫酸钠溶液合并,其中还会含有过量的氢氧化钠,所以显示碱性,应该加硫酸调节pH到中性,不能引进杂质离子,可以选择硫酸,硫酸钠溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥可以得到硫酸钠的晶体.
故答案为:H2SO4;蒸发浓缩;过滤;
(4)PbO和碳酸铅中加入硝酸,可以得到硝酸铅溶液,同时放出二氧化碳气体,步骤②中共收集到5.6L即0.25molCO2(标准状态),根据碳元素守恒,
所以含有碳酸铅是0.25mol,步骤③中获得90.9g即0.3molPbSO4,根据Pb守恒,这些Pb都来自PbO和碳酸铅,所以PbO的物质的量是0.3mol-0.25mol=0.05mol,PbO的质量分数为
×100%=14.3%.
故答案为:14.3%.
(1)铅膏中PbSO4与Na2CO3溶液反应转化为PbCO3和硫酸钠溶液,PbSO4转化为PbCO3,说明溶解度:PbSO4的要大于碳酸铅的,沉淀是向着更难溶的方向转化;
故答案为:>;
(2)反应PbO2+SO32-+CO32-+?→PbCO3↓+SO42-+OH-中,Pb的化合价降低了2价,S的化合价升高了2价,所以PbO2、SO32-、PbCO3、SO42-的系数都是1,根据碳元素守恒,CO32-,的系数是1,根据电荷守恒,OH-的系数是2,根据H元素守恒,反应物中应该添加H2O,即PbO2+SO32-+CO32-+H2O=PbCO3↓+SO42-+2OH-,
故答案为:1,1,1,1,H2O,1,1,2;
(3)将步骤①和④的滤液即硫酸钠溶液合并,其中还会含有过量的氢氧化钠,所以显示碱性,应该加硫酸调节pH到中性,不能引进杂质离子,可以选择硫酸,硫酸钠溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥可以得到硫酸钠的晶体.
故答案为:H2SO4;蒸发浓缩;过滤;
(4)PbO和碳酸铅中加入硝酸,可以得到硝酸铅溶液,同时放出二氧化碳气体,步骤②中共收集到5.6L即0.25molCO2(标准状态),根据碳元素守恒,
所以含有碳酸铅是0.25mol,步骤③中获得90.9g即0.3molPbSO4,根据Pb守恒,这些Pb都来自PbO和碳酸铅,所以PbO的物质的量是0.3mol-0.25mol=0.05mol,PbO的质量分数为
| 0.05mol×223g/mol |
| 78g |
故答案为:14.3%.
点评:本题考查较综合,涉及混合物的分离和提纯、氧化还原反应等知识点,能从整体上分析、把握制取原理,知道亚硫酸盐和二氧化铅能发生氧化还原反应,题目难度中等.

练习册系列答案
相关题目
25℃时,下列溶液中微粒存在情况合理的是( )
| A、Fe2+、Mg2+、ClO-、Cl-能大量共存 | ||
| B、滴入酚酞试液显红色的溶液中:K+、Na+、NO3-、SO42- | ||
C、含大量K+、Na+、NO3-、CO32-的溶液中c(H+)=
| ||
| D、C(Fe3+)=0.1 mol/L的溶液中:NH4+、Al3+、I-、SO42- |
能将NH4NO3、Na2SO4、KCl、(NH4)2SO4四种溶液一步加以区别(可以加热)的试剂为( )
| A、BaCl2 |
| B、Ba(NO3)2 |
| C、Ba(OH)2 |
| D、AgNO3 |
光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:据此,下列判断中正确的是( )
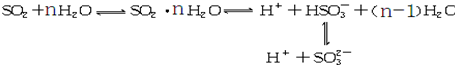
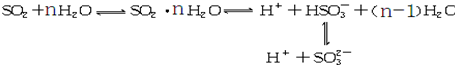
| A、该溶液中所含微粒种类至少6种 |
| B、向该溶液中加入少量BaCl2固体,上述平衡向正向移动 |
| C、向该溶液中加入足量的酸都能放出SO2气体 |
| D、该溶液中:C(H+)>C(HSO3-)>C(SO32-) |
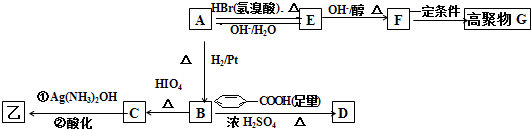
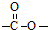 结构的基团,B在HIO4存在并加热时只生成一种产物C,下列为各相关反应的信息和转化关系:
结构的基团,B在HIO4存在并加热时只生成一种产物C,下列为各相关反应的信息和转化关系: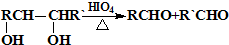
 电化学在工业生产中有广泛应用.如图所示,水槽中试管内有一枚铁钉,放置数天观察,发现铁钉被腐蚀.
电化学在工业生产中有广泛应用.如图所示,水槽中试管内有一枚铁钉,放置数天观察,发现铁钉被腐蚀.