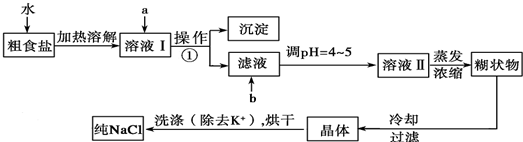
题目内容
为了证明醋酸是弱电解质,甲、乙、丙、丁、戊、己、庚七人分别选用下列试剂进行实验:
0.01mol?L-1醋酸溶液、0.1mol?L-1CH3COONa溶液、pH=3的盐酸、pH=3的醋酸、CH3COONa晶体、NaCl晶体、甲基橙、pH试纸、蒸馏水.
(1)甲用pH试纸测出0.10mol?L-1的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗? .(填“正确”或“不正确”)
(2)乙取出10mL 0.10mol?L-1的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏水稀释到1 000mL,再用pH试纸测定其pH=b,要确定醋酸是弱电解质,则a、b应该满足的关系是 .
(3)丙取出10mL 0.10mol?L-1醋酸溶液,滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,你认为这一方法能否证明醋酸是弱电解质? (填“能”或“不能”).
(4)丁将pH=3的醋酸和盐酸,各取10mL,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小,则认定醋酸是弱电解质,你认为这一方法正确吗? (填“正确”或“不正确”).
(5)戊将pH=3的醋酸和盐酸,分别加入相应的钠盐固体,醋酸的pH变化大,则认定醋酸是弱电解质,你认为这一方法正确吗? (填“正确”或“不正确”).
(6)己取pH=3的盐酸和醋酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,醋酸放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗? (填“正确”或“不正确”).
(7)庚用pH试纸来测定0.1mol?L-1CH3COONa溶液的pH值,发现0.1mol?L-1 CH3COONa溶液的pH值为11,则认定醋酸是弱电解质,你认为这一方法正确吗? (填“正确”或“不正确”).
0.01mol?L-1醋酸溶液、0.1mol?L-1CH3COONa溶液、pH=3的盐酸、pH=3的醋酸、CH3COONa晶体、NaCl晶体、甲基橙、pH试纸、蒸馏水.
(1)甲用pH试纸测出0.10mol?L-1的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗?
(2)乙取出10mL 0.10mol?L-1的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏水稀释到1 000mL,再用pH试纸测定其pH=b,要确定醋酸是弱电解质,则a、b应该满足的关系是
(3)丙取出10mL 0.10mol?L-1醋酸溶液,滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,你认为这一方法能否证明醋酸是弱电解质?
(4)丁将pH=3的醋酸和盐酸,各取10mL,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小,则认定醋酸是弱电解质,你认为这一方法正确吗?
(5)戊将pH=3的醋酸和盐酸,分别加入相应的钠盐固体,醋酸的pH变化大,则认定醋酸是弱电解质,你认为这一方法正确吗?
(6)己取pH=3的盐酸和醋酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,醋酸放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗?
(7)庚用pH试纸来测定0.1mol?L-1CH3COONa溶液的pH值,发现0.1mol?L-1 CH3COONa溶液的pH值为11,则认定醋酸是弱电解质,你认为这一方法正确吗?
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)弱酸部分电离,其氢离子的浓度小于酸的浓度;
(2)醋酸为弱电解质,溶液中部分电离,pH变化较慢;
(3)滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,说明醋酸钠的加入引起了溶液中c(H+)变化,只有弱电解质才存在电离平衡;
(4)醋酸为弱电解质,溶液中部分电离,加水稀释pH变化小;
(5)从弱电解质的电离平衡移动的角度分析;
(6)醋酸为弱电解质,溶液中部分电离,加水稀释,醋酸的电离程度增大,溶液中氢离子浓度大于盐酸溶液的;
(7)盐溶液显碱性,说明盐的酸根离子为弱酸根.
(2)醋酸为弱电解质,溶液中部分电离,pH变化较慢;
(3)滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,说明醋酸钠的加入引起了溶液中c(H+)变化,只有弱电解质才存在电离平衡;
(4)醋酸为弱电解质,溶液中部分电离,加水稀释pH变化小;
(5)从弱电解质的电离平衡移动的角度分析;
(6)醋酸为弱电解质,溶液中部分电离,加水稀释,醋酸的电离程度增大,溶液中氢离子浓度大于盐酸溶液的;
(7)盐溶液显碱性,说明盐的酸根离子为弱酸根.
解答:
解:(1)弱酸部分电离,其氢离子的浓度小于酸的浓度,甲用pH试纸测出0.10mol/L的醋酸溶液pH=4,说明醋酸为弱酸;故答案为:正确;
(2)取出10mL0.1mol?L-1醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏水稀释到1000mL,在用pH试纸测定其pH=b,若醋酸为弱电解质,溶液中氢离子浓度变化小于原来的100倍,则溶液的pH<a+2,所以b<a+2;
故答案为:b<a+2;
(3)滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,说明溶液中c(H+)变化,说明存在平衡移动过程,醋酸溶液部分电离,加入醋酸钠,醋酸根离子浓度增大,平衡逆向移动,c(H+)减小,证明醋酸为弱电解质;
故答案为:能;
(4)将pH=3醋酸和盐酸,各取10ml,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小,说明稀释过程中醋酸电离程度增大,溶液中氢离子的物质的量增大,所以醋酸是弱电解质;
故答案为:正确;
(5)盐酸是强酸,相应的钠盐的水溶液呈中性,即PH=7,醋酸溶液中存在CH3COOH?CH3COO-+H+,加入CH3COONa,溶液CH3COO-浓度增大,抑制醋酸电离,溶液c(H+)减小,说明醋酸为弱酸,
故答案为:正确;
(6)取pH=3的盐酸和醋酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,醋酸放出H2的速率快,说明加水稀释,醋酸的电离程度增大,溶液中氢离子浓度大于盐酸溶液的,证明醋酸为弱电解质;
故答案为:正确;
(7)用pH试纸来测定0.1mol/L醋酸钠溶液的pH值,发现0.1mol/L醋酸钠溶液的pH值为11,说明溶液显碱性,说明盐的酸根离子为弱酸根,则认定醋酸是弱电解质,
故答案为:正确.
(2)取出10mL0.1mol?L-1醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏水稀释到1000mL,在用pH试纸测定其pH=b,若醋酸为弱电解质,溶液中氢离子浓度变化小于原来的100倍,则溶液的pH<a+2,所以b<a+2;
故答案为:b<a+2;
(3)滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,说明溶液中c(H+)变化,说明存在平衡移动过程,醋酸溶液部分电离,加入醋酸钠,醋酸根离子浓度增大,平衡逆向移动,c(H+)减小,证明醋酸为弱电解质;
故答案为:能;
(4)将pH=3醋酸和盐酸,各取10ml,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小,说明稀释过程中醋酸电离程度增大,溶液中氢离子的物质的量增大,所以醋酸是弱电解质;
故答案为:正确;
(5)盐酸是强酸,相应的钠盐的水溶液呈中性,即PH=7,醋酸溶液中存在CH3COOH?CH3COO-+H+,加入CH3COONa,溶液CH3COO-浓度增大,抑制醋酸电离,溶液c(H+)减小,说明醋酸为弱酸,
故答案为:正确;
(6)取pH=3的盐酸和醋酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,醋酸放出H2的速率快,说明加水稀释,醋酸的电离程度增大,溶液中氢离子浓度大于盐酸溶液的,证明醋酸为弱电解质;
故答案为:正确;
(7)用pH试纸来测定0.1mol/L醋酸钠溶液的pH值,发现0.1mol/L醋酸钠溶液的pH值为11,说明溶液显碱性,说明盐的酸根离子为弱酸根,则认定醋酸是弱电解质,
故答案为:正确.
点评:本题考查了比较强电解质与弱电解质的实验,题目难度中等,解题根据是明确弱电解质与弱电解质的概念及二者本质区别:强电解质完全电离、弱电解质部分电离.

练习册系列答案
相关题目
25℃时,下列溶液中微粒存在情况合理的是( )
| A、Fe2+、Mg2+、ClO-、Cl-能大量共存 | ||
| B、滴入酚酞试液显红色的溶液中:K+、Na+、NO3-、SO42- | ||
C、含大量K+、Na+、NO3-、CO32-的溶液中c(H+)=
| ||
| D、C(Fe3+)=0.1 mol/L的溶液中:NH4+、Al3+、I-、SO42- |
下列说法不正确的是( )
| A、易溶于水的固体物质与水用蒸馏的方法分离 |
| B、互溶的液体用蒸馏的方法分离 |
| C、互不相容的两种液体用分液的方法分离 |
| D、难溶于水的物质与水用过滤的方法分离 |
现有一瓶甲、乙的混合物,已知它们的性质如下表,据此,将甲、乙互相分离的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 甲 | -11.5℃ | 198℃ | 1.11 g?mL-1 | A、B互溶且均易溶于水 |
| 乙 | -17.9℃ | 290℃ | 1.26 g?mL-1 |
| A、萃取法 | B、蒸馏法 |
| C、分液法 | D、结晶法 |
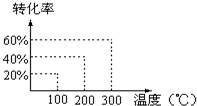 将X和Y以1:2的体积比混合后置于密闭容器中,加压到3×107Pa,发生如下反应:(g)+2Y(g)?2Z(g),达到平衡状态时,测得反应物的总物质的量和生成物的总物质的量相等,有关数据如图,则反应对应的温度是( )
将X和Y以1:2的体积比混合后置于密闭容器中,加压到3×107Pa,发生如下反应:(g)+2Y(g)?2Z(g),达到平衡状态时,测得反应物的总物质的量和生成物的总物质的量相等,有关数据如图,则反应对应的温度是( )| A、100℃ | B、200℃ |
| C、300℃ | D、不能确定 |
光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:据此,下列判断中正确的是( )
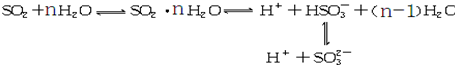
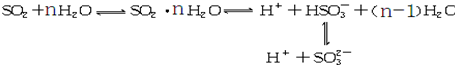
| A、该溶液中所含微粒种类至少6种 |
| B、向该溶液中加入少量BaCl2固体,上述平衡向正向移动 |
| C、向该溶液中加入足量的酸都能放出SO2气体 |
| D、该溶液中:C(H+)>C(HSO3-)>C(SO32-) |
晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如图所示,下列说法正确的是( )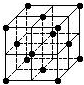

| A、C60属于离子晶体 |
| B、C60摩尔质量是720 |
| C、在C60晶胞中平均每个晶胞有14个C60分子 |
| D、每个C60分子周围与它距离最近等距离的C60分子有12个 |