题目内容
4.下列各组物质中一定互为同系物的是( )| A. | C3H4;C5H8 | B. | C3H8;C5H12 | ||
| C. | CH3-CH2-CH2-CH3 ; | D. | C2H5Cl;C3H6Cl2 |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,注意互为同系物的有机物分子中含有的官能团种类及数目一定相同,据此进行解答.
解答 解:A.C3H4和C5H8不一定具有相似结构,所以二者不一定互为同系物,故A错误;
B.C3H8和C5H12都是烷烃,二者结合相似,分子间相差2个CH2原子团,所以二者一定互为同系物,故B正确;
C.CH3-CH2-CH2-CH3 和 的分子式相同、结构不同,二者互为同分异构体,故C错误;
的分子式相同、结构不同,二者互为同分异构体,故C错误;
D.C2H5Cl和C3H6Cl2含有的氯原子数目不同,二者的结构不相似,所以不互为同系物,故D错误;
故选B.
故选C.
点评 本题考查同系物的判断,题目难度不大,明确同系物的概念为解答关键,注意掌握同系物、同分异构体、同素异形体、同位素等概念及区别,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
14.用下列装置完成相关实验,不合理的是( )
| A. |  用a趁热过滤提纯苯甲酸 | B. |  用b制备并检验乙烯 | ||
| C. |  用c制无水乙醇 | D. |  用d分离硝基苯与水 |
15.能源问题是当今世界上困扰人类发展的重大问题之一,而太阳能资源却非常丰富,开发和利用太阳能将大大缓解能源供需矛盾.下列说法不正确的是( )
| A. | 太阳能发电技术是将化学能转化为电能 | |
| B. | 集热技术是将太阳能转化为热能 | |
| C. | 光-热转化是目前技术最成熟、成本最低廉、应用最广泛的利用太阳能形式 | |
| D. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 |
19.乙酸乙酯在KOH溶液中水解,得到的产物是( )
| A. | 乙酸钾 | B. | 甲醇 | C. | 乙醇 | D. | 乙酸 |
3.硫酸是中学最常见的三大强酸之一,某研究性学习小组探究外界条件对铁与硫酸反应速率的影响.
[实验设计]控制用同种铁块,初始使用硫酸体积均为1000mL,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验.
(1)请完成以下实验设计表(表中不要留空格).
[解释与结论]
(2)实验①、②表明温度越高,反应速率越快
请再提出一种加快该反应速率的方法增大同质量铁的表面积或加入少量硫酸铜,构成原电池
(3)实验③得出的结论是:当硫酸浓度为18.4mol/L,反应速率趋向于零(反应速率趋向于停止),原因是常温下,铁与浓硫酸发生钝化
[思考与交流]
(4)实验③,若t1时开始加热,在铁的表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变.甲同学将收集到的气体体积与时间的关系粗略地表示为图2.t1~t2时间段,反应生成的气体是SO2、H2.写出开始加热时发生反应的化学方程式:2Fe+6H2SO4(浓)═Fe2(SO4)3+3SO2↑+6H2O.
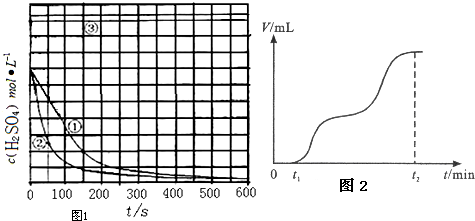
[实验设计]控制用同种铁块,初始使用硫酸体积均为1000mL,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验.
(1)请完成以下实验设计表(表中不要留空格).
| 实验 编号 | 实验目的 | T/K | Fe/g | c(H2SO4)/mol•L-1 |
| ① | 为以下实验作参考 | 298 | 10 | 1.0 |
| ② | 探究温度对反应速率的影响 | |||
| ③ | 298 | 10 | 18.4 |
(2)实验①、②表明温度越高,反应速率越快
请再提出一种加快该反应速率的方法增大同质量铁的表面积或加入少量硫酸铜,构成原电池
(3)实验③得出的结论是:当硫酸浓度为18.4mol/L,反应速率趋向于零(反应速率趋向于停止),原因是常温下,铁与浓硫酸发生钝化
[思考与交流]
(4)实验③,若t1时开始加热,在铁的表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变.甲同学将收集到的气体体积与时间的关系粗略地表示为图2.t1~t2时间段,反应生成的气体是SO2、H2.写出开始加热时发生反应的化学方程式:2Fe+6H2SO4(浓)═Fe2(SO4)3+3SO2↑+6H2O.

10.某无色溶液中可能含有Na+、K+、Fe3+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①pH试纸检验,溶液的pH>7.
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液.
④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤.
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生.
则关于原溶液的判断中不正确的是( )
①pH试纸检验,溶液的pH>7.
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液.
④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤.
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生.
则关于原溶液的判断中不正确的是( )
| A. | 肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32- | |
| B. | 肯定存在的离子是Na+、K+、SO32-、Br-、Cl- | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤 ④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
7.下列实验操作或记录正确的是( )
| A. | 用量筒测得排水法收集制得的氢气体积为5.28 mL | |
| B. | 用两只250 mL的容量瓶配制0.1mol/L 500 mL的NaOH溶液 | |
| C. | 用托盘天平称得2.50g胆矾,受热充分失水后,固体质量减轻0.90g | |
| D. | 常温下,测得1molN2的质量为28g |
8.下列排列顺序不正确的是( )
| A. | 元素的非金属性:N<O<F | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 热稳定性:HF>HCl>H2S | D. | 原子半径:Al>Mg>Na |
 .
.