题目内容
7.(1)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭.在农村推广建造沼气池,不仅能有效地利用生物质能,还能为农业生产提供优良的肥料.已知:标准状况下的112.0L CH4气体完全燃烧,生成CO2和液态水,放出4448kJ的热量.
①写出CH4完全燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.
②如果上述反应生成的是水蒸气,则反应放出的热量<4448kJ.(填“>”或“<”或“=”)
(2)已知拆开1mol H-H键、1molN≡N、1mol N-H键分别需要吸收的能量为436.4kJ、941,.3kJ、390.5kJ.则由1 mol NH3分解生成氢气和氮气需要吸收(填“放出”或“吸收”)46.25kJ的热量.
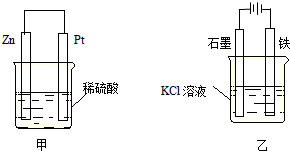
(3)在生产和生活中经常遇到化学能与电能的相互转化.在下列甲、乙两装置中,甲中负极电极反应式为Zn-2e-=Zn2+;乙中铁电极的电极反应式为2H++2e-=H2↑,铁电极发生还原反应(填“氧化”或“还原”).
分析 (1)秸秆、杂草等废弃物.它们经微生物发酵之后,便可产生沼气,可用来点火做饭或发电照明,说明是生物能转化为化学能;依据热化学方程式书写热化学方程式,标注物质聚集状态和对应反应的焓变;
(2)断裂化学键需要吸收能量,形成化学键需要放出能量,放出的能量少,吸收的能量多,该反应为吸热反应,根据焓变等于反应物的键能减去生成物的键能计算;
(3)甲中锌作负极,失去电子,发生氧化反应,电极反应式为Zn-2e-=Zn2+;乙中铁电极为阴极,得电子发生还原反应,电极反应式为2H++2e-=H2↑.
解答 解:(1)秸秆、杂草等废弃物.它们经微生物发酵之后,便可产生沼气,可用来点火做饭或发电照明,说明是生物质能转化为化学能;
①已知标准状况下11.2L甲烷物质的量为0.5mol,完全燃烧生成液态水时放出445kJ的热量,所以1mol甲烷烷醛燃烧生成二氧化碳和液态水放热890.0kJ,甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol;
故答案为:生物能,CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol;
②如果上述反应生成的是水蒸气,液态转变为气态要吸收热量,故反应放出的热量小于4448kJ,故答案为:<;
(2)已知拆开1mol H-H键、1molN≡N、1mol N-H键分别需要吸收的能量为436.4kJ、941,.3kJ、390.5kJ.形成3mol H-H键,1mol N三N键共放出的能量为:3×436kJ+946kJ=2254kJ,分解2mol NH3,共断裂6mol N-H键,吸收的能量为:6×391kJ=2346kJ,放出的能量少,吸收的能量多,该反应为吸热反应,分解1molNH3放出的热量为:2346.5kJ-2254kJ=92.5kJ,所以生成1molNH3吸收的热量为46.25KJ,
故答案为:吸收;46.25kJ;
(3)甲中锌作负极,失去电子,电极反应式为Zn-2e-=Zn2+;乙中铁电极为阴极,得电子发生还原反应,电极反应式为2H++2e-=H2↑,
故答案为:Zn-2e-=Zn2+;还原;2H++2e-=H2↑.
点评 本题考查了热化学方程式的书写和计算应用,掌握书写原则是关键,题目较简单.

| A. | 硫化氢在氧气中燃烧 | B. | 铁在硫蒸气中燃烧 | ||
| C. | 二氧化硫通入石灰水 | D. | 锌粉和硫酸反应 |
| A. | 2-丙醇的结构式:CH3CHOHCH3 | |
| B. | 丙烯分子的结构简式为 CH3CH CH 2 | |
| C. | 四氯化碳分子的电子式为: | |
| D. | 2-乙基-1,3-丁二烯的键线式: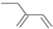 |
| A. | 太阳能发电技术是将化学能转化为电能 | |
| B. | 集热技术是将太阳能转化为热能 | |
| C. | 光-热转化是目前技术最成熟、成本最低廉、应用最广泛的利用太阳能形式 | |
| D. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 |
| A. | Cl2 | B. | NH4Cl | C. | C2H6 | D. | KOH |
| A. | 乙酸钾 | B. | 甲醇 | C. | 乙醇 | D. | 乙酸 |
①pH试纸检验,溶液的pH>7.
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液.
④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤.
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生.
则关于原溶液的判断中不正确的是( )
| A. | 肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32- | |
| B. | 肯定存在的离子是Na+、K+、SO32-、Br-、Cl- | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤 ④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
Ⅰ.制取氯化锌主要工艺如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.9 | 8.9 |
| Fe2+ | 5.8 | 8.8 |
(1)为了加快反应,“酸溶”需要适当加热,但是温度不宜太高,原因是防止金属离子水解形成沉淀,以及温度过高H2O2发生分解.
(2)沉淀A的化学式为Cu.
(3)调节pH的范围为3.2≤pH<5.2;若试剂X为Zn2(OH)2CO3,加人X除杂质的离子方程为Zn2(OH)2CO3+4H+=2Zn2++3H2O+CO2↑.
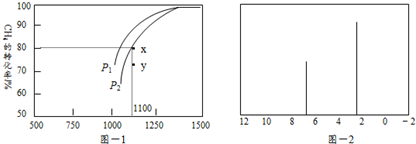
 .
.