题目内容
17.A、B、C、D均为中学化学所学的常见物质,且都含有短周期内同一种元素,它们之间的转化关系如下图所示(反应条件及其它产物已略去):A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D请填写下列空白:
(1)若A为某单质,D是一种二元弱酸,则B是CO(填写化学式);A+C→B 化学方程式是CO2+C $\frac{\underline{\;高温\;}}{\;}$2CO.
(2)若A为气体,其水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红.则工业上合成A的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
(3)若A是金属单质,C是淡黄色粉末.D遇酚酞溶液变红,C电子式:
 由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
分析 (1)若A为某单质,D是一种二元弱酸,则A为非金属单质,判断为C,则B为CO,C为CO2,D为H2CO3;
(2)根据使湿润的红色石蕊试纸变蓝确定A是氨气,进而确定D是硝酸,工业合成氨是氮气和氢气在高温高压催化剂作用下反应生成氨气;
(3)若A为活泼金属元素的单质,C是淡黄色固体,应为Na2O2,故A为Na,B为Na2O,D为NaOH,过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物.
解答 解:(1)若A为某单质,D是一种二元弱酸,则A为非金属单质,判断为C,则B为CO,C为CO2,D为H2CO3,A+C→B 化学方程式是:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO,
故答案为:CO;CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;
(2)A的水溶液能使湿润的红色石蕊试纸变蓝,说明A是氨气,则B是一氧化氮,C是二氧化氮,D是硝酸,工业合成氨是氮气和氢气在高温高压催化剂作用下反应生成氨气,反应的化学方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3 ,
故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;
(3)若A为活泼金属元素的单质,C是淡黄色固体,应为Na2O2,D遇酚酞溶液变红,D位氢氧化钠,故A为Na,B为Na2O,D为NaOH,过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为 ,C与水反应是过氧化钠和水反应生成氢氧化钠和氧气,2Na2O2+2H2O=4NaOH+O2↑,
,C与水反应是过氧化钠和水反应生成氢氧化钠和氧气,2Na2O2+2H2O=4NaOH+O2↑,
故答案为: ;2Na2O2+2H2O=4NaOH+O2↑.
;2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查元素化合物的推断,涉及S、N、Na元素单质及其化合物性质与转化,难度中等,需要学生熟练掌握元素化合物知识,把握反应的规律,注意相关基础知识的积累,题目难度中等.

| A. | ②③④① | B. | ④②③① | C. | ④③①② | D. | ②①③④ |
| A. | 3.7 g的2H35Cl含质子数为1.9NA | |
| B. | 16 g O3和O2混合物中氧原子数为NA | |
| C. | 100 mL 1 mol•L-1AlCl3溶液中含的阳离子数等于0.1NA | |
| D. | 标准状况下,33.6 L氯气与28 g铁充分反应,转移的电子数为3NA |
| A | ①能使溴的四氯化碳溶液褪色 ②比例模型如图 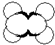 ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成 ②球棍模型如图 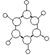 |
| C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊试液变红 |
(1)A与溴水反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学方程式:
 .
.(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH 2n+2.当n=5时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤任何条件下不与氢气反应 ⑥可使酸性高锰酸钾溶液和溴水均褪色写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 ;
;(4)写出由C氧化生成D的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
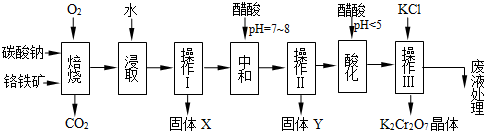
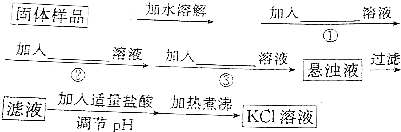
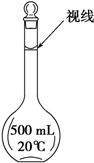 实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有: ,M中阴离子的离子符号为O22-.
,M中阴离子的离子符号为O22-.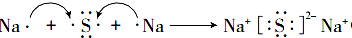 .
.