题目内容
某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
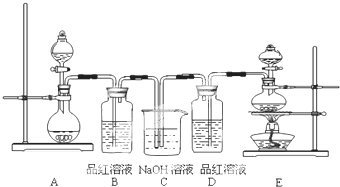
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质
(2)反应开始后,发现B、D两个装置中的品红溶液都褪色,停止通气后,分别取少量B、D两个装置中的液体于试管中加热,两个试管中的现象分别为:
B D
(3)装置C的作用是
(4)写出等物质的量的Cl2与SO2反应的离子方程式 .

(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质
(2)反应开始后,发现B、D两个装置中的品红溶液都褪色,停止通气后,分别取少量B、D两个装置中的液体于试管中加热,两个试管中的现象分别为:
B
(3)装置C的作用是
(4)写出等物质的量的Cl2与SO2反应的离子方程式
考点:探究二氧化硫与水和品红溶液的反应,探究氯水、氯气的漂白作用
专题:
分析:(1)根据氯元素的化合价判断其表现的性质;
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,注意次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;
(3)根据氢氧化钠及二氧化硫和氯气的性质分析;
(4)二氧化硫具有还原性,能被氯气氧化.
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,注意次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;
(3)根据氢氧化钠及二氧化硫和氯气的性质分析;
(4)二氧化硫具有还原性,能被氯气氧化.
解答:
解:(1)实验室制取氯气的反应方程式为:MnO2+4HCl
MnCl2+Cl2↑+2H2O,由HCl生成MnCl2,氯元素化合价不变,
由HCl生成Cl2,氯元素化合价升高,所以浓盐酸所表现出的性质是酸性和还原性,
故答案为:还原性和酸性;
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时能重新变成红色,
故答案为:溶液由无色变成红色;溶液没有明显变化;
(3)氯气和二氧化硫有毒,不能排放到空气中,但氯气和二氧化硫都和碱反应,所以装置C的作用是保证安全,吸收多余的氯气和二氧化硫,
故答案为:吸收多余的SO2和Cl2,防止污染环境;
(4)二氧化硫具有还原性,能被氯气氧化,即Cl2+SO2+2H2O═H2SO4+2HCl,离子方程式为Cl2+SO2+2H2O═4H++SO42-+2Cl-,故答案为:Cl2+SO2+2H2O═4H++SO42-+2Cl-.
| ||
由HCl生成Cl2,氯元素化合价升高,所以浓盐酸所表现出的性质是酸性和还原性,
故答案为:还原性和酸性;
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时能重新变成红色,
故答案为:溶液由无色变成红色;溶液没有明显变化;
(3)氯气和二氧化硫有毒,不能排放到空气中,但氯气和二氧化硫都和碱反应,所以装置C的作用是保证安全,吸收多余的氯气和二氧化硫,
故答案为:吸收多余的SO2和Cl2,防止污染环境;
(4)二氧化硫具有还原性,能被氯气氧化,即Cl2+SO2+2H2O═H2SO4+2HCl,离子方程式为Cl2+SO2+2H2O═4H++SO42-+2Cl-,故答案为:Cl2+SO2+2H2O═4H++SO42-+2Cl-.
点评:本题考查了次氯酸和二氧化硫的漂白性,难度不大,注意次氯酸和二氧化硫漂白性的不同,次氯酸的漂白性是利用其强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质反应生成无色物质.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
在一定条件下,对于反应2A(g)+B(g)?2C(g),下列说法中正确的是( )
A、此反应的平衡常数K=
| ||
| B、改变条件该反应的平衡常数K一定不变 | ||
| C、改变压强并加入催化剂,平衡常数会随之变化 | ||
| D、平衡时增大A和B的浓度,平衡常数会减小 |
将浓度都为1mol/L的Na2CO3溶液和稀H2SO4按体积比2:1混合,则下列说法正确的是( )
| A、混合溶液的pH<7 |
| B、混合溶液中:c(SO42-)+c(OH-)<c(HCO3-)+c(H2CO3)+c(CO32-) |
| C、混合溶液中:c(Na+)+c(H+)<2[c(SO42-)+c(CO32-)] |
| D、混合溶液中离子浓度大小顺序是:c(Na+)>c(HCO3-)>c(OH-)>c(SO42-)>c(H+) |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.