题目内容
等浓度等体积的NaHCO3溶液和Na2SO3溶液混合,则混合溶液中各离子浓度大小顺序是: .
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:NaHCO3溶液和Na2SO3溶液中的阴离子都是弱离子,存在水解平衡,但是碳酸氢根离子的水解程度大于亚硫酸根离子的水解程度,碳酸氢根离子的电离程度更小,据此确定离子浓度大小.
解答:
解:NaHCO3溶液和Na2SO3溶液中的阴离子都是弱离子,存在水解平衡,但是碳酸氢根离子的水解程度大于亚硫酸根离子的水解程度,碳酸氢根离子的电离程度更小,所以c(SO32-)>c(HCO3-),溶液显示碱性,所以c(H+)<c(OH-),钠离子是直接电离出的离子,所以钠离子浓度最大,亚硫酸根离子水解得到的亚硫酸氢根离子的电离程度较小,水解程度更小,则混合溶液中各离子浓度大小顺序是以c(Na+)>c(SO32-)>c(HCO3-)>c(OH-)>c(HSO3-)>c(CO32-)>c(H+),
故答案为:c(Na+)>c(SO32-)>c(HCO3-)>c(OH-)>c(HSO3-)>c(CO32-)>c(H+).
故答案为:c(Na+)>c(SO32-)>c(HCO3-)>c(OH-)>c(HSO3-)>c(CO32-)>c(H+).
点评:本题考查学生酸式酸根阴离子的水解以及电离以及离子浓度大小比较知识,属于综合知识的考查,难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
在溶液中能大量共存的离子组是( )
| A、Mg2+、NH4+、NO3-、Cl- |
| B、Ba2+、Na+、NO3-、CO32- |
| C、K+、Mg2+、SO42-、CO32- |
| D、H+、Na+、HCO3-、SO42- |
在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(固)+3B(气)?2C(气)+D(气)已达平衡状态的是(其中只有B气体有颜色)( )
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、气体的平均分子量 |
| D、气体的颜色 |
 在下列反应中:A2(g)+B2(g)?2AB(g)△H<0,当其达到平衡时,图象中曲线正确的是( )
在下列反应中:A2(g)+B2(g)?2AB(g)△H<0,当其达到平衡时,图象中曲线正确的是( )| A、① | B、② | C、③ | D、⑤ |
化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等.下列说法不正确的是( )
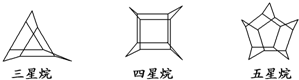

| A、它们之间互为同系物 |
| B、三星烷的化学式为C9H12 |
| C、三星烷与丙苯互为同分异构体 |
| D、它们的一氯代物均只有两种 |
 )和抗癫痫药物H(
)和抗癫痫药物H( )的路线如下(部分反应略去条件和试剂):
)的路线如下(部分反应略去条件和试剂):
 +H2O(R、R′表示烃基或氢)
+H2O(R、R′表示烃基或氢) )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式