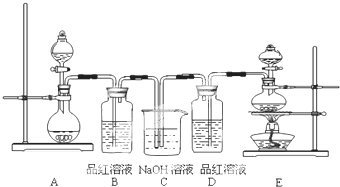
题目内容
卤化物和卤酸盐在工业生产中有着重要的作用.某小组为探究其中一些盐的性质,查阅资料并进行实验.查阅资料如下:
①KBrO3+6KI+3H2SO4=3I2+KBr+3H2O+3K2SO4
②2KBrO3+I2=2KIO3+Br2
③KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
④2KIO3+10KBr+6H2SO4=I2+5Br2+6H2O+6K2SO4
实验如下:
请回答下列问题:
(1)步骤ⅰ开始时发生的反应如资料中的①所示,溶液中I-完全被氧化时转移 mol e-.
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴.
(3)根据资料中的反应①~④并结合所学知识,判断KIO3、KBrO3、I2、Br2的氧化性由强到弱的顺序是 ;
(4)当n(KBrO3)=0.004mol时,体系中对应含碘物质的化学式为: .
①KBrO3+6KI+3H2SO4=3I2+KBr+3H2O+3K2SO4
②2KBrO3+I2=2KIO3+Br2
③KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
④2KIO3+10KBr+6H2SO4=I2+5Br2+6H2O+6K2SO4
实验如下:
| 步骤 | 现象 |
| ⅰ.向盛有30mL 0.2mol?L-1KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
(1)步骤ⅰ开始时发生的反应如资料中的①所示,溶液中I-完全被氧化时转移
(2)上述资料中的反应
(3)根据资料中的反应①~④并结合所学知识,判断KIO3、KBrO3、I2、Br2的氧化性由强到弱的顺序是
(4)当n(KBrO3)=0.004mol时,体系中对应含碘物质的化学式为:
考点:氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:(1)根据n=cV计算溶液中n(I-),反应中I-是还原剂,被氧化为I2,化合价由-1价升高为0价,据此计算;
(2)步骤ⅱ中溶液的蓝色逐渐褪去,说明I2被氧化,该反应只能说明I2的还原性比Br2强;
(3)根据氧化剂氧化性强于氧化产物的氧化性进行判断;
(4)当n(KBrO3)=0.004mol时,发生的反应依次有6I-+BrO3-=Br-+3I2,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,据此计算;
(2)步骤ⅱ中溶液的蓝色逐渐褪去,说明I2被氧化,该反应只能说明I2的还原性比Br2强;
(3)根据氧化剂氧化性强于氧化产物的氧化性进行判断;
(4)当n(KBrO3)=0.004mol时,发生的反应依次有6I-+BrO3-=Br-+3I2,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,据此计算;
解答:
解:(1)溶液中n(I-)=0.03L×0.2mol?L-1=0.006mol,反应中I-是还原剂,被氧化为I2,化合价由-1价升高为0价,故转移电子物质的量为0.006mol×1=0.006mol,
故答案为:0.006mol;
(2)步骤ⅱ中溶液的蓝色逐渐褪去,说明I2被氧化,发生反应②2BrO3-+I2=2IO3-+Br2,该反应中还原剂为I2,能说明I2的还原性比Br2强,但不能说明碘的非金属性强于溴,故答案为:②;不能;
(3)由反应①可知,氧化性BrO3->I2,由反应②可知,氧化性BrO3->IO3-,由反应③可知,氧化性IO3->I2,由反应④可知,氧化性IO3->Br2,故氧化性BrO3->IO3->Br2>I2,
故答案为:KBrO3>KIO3>Br2>I2;
(4)n(KBrO3)=0.004时,发生的反应依次有6I-+BrO3-=Br-+3I2,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,0.006molKI生成I2,需要0.001molKBrO3,同时生成0.001molKBr,发生BrO3-+5Br-+6H+=3Br2+3H2O,需要0.0002molKBrO3,如I2完全被氧化生成KIO3,还应需要0.006molKBrO3,则n(KBrO3)=0.004时,对应含碘物质的化学式为I2,KIO3,故答案为:I2、KIO3.
故答案为:0.006mol;
(2)步骤ⅱ中溶液的蓝色逐渐褪去,说明I2被氧化,发生反应②2BrO3-+I2=2IO3-+Br2,该反应中还原剂为I2,能说明I2的还原性比Br2强,但不能说明碘的非金属性强于溴,故答案为:②;不能;
(3)由反应①可知,氧化性BrO3->I2,由反应②可知,氧化性BrO3->IO3-,由反应③可知,氧化性IO3->I2,由反应④可知,氧化性IO3->Br2,故氧化性BrO3->IO3->Br2>I2,
故答案为:KBrO3>KIO3>Br2>I2;
(4)n(KBrO3)=0.004时,发生的反应依次有6I-+BrO3-=Br-+3I2,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,0.006molKI生成I2,需要0.001molKBrO3,同时生成0.001molKBr,发生BrO3-+5Br-+6H+=3Br2+3H2O,需要0.0002molKBrO3,如I2完全被氧化生成KIO3,还应需要0.006molKBrO3,则n(KBrO3)=0.004时,对应含碘物质的化学式为I2,KIO3,故答案为:I2、KIO3.
点评:本题考查氧化还原反应及计算、对信息的利用,难度中等,是对学生综合能力的考查.

练习册系列答案
相关题目
化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等.下列说法不正确的是( )
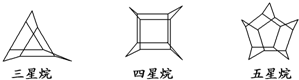

| A、它们之间互为同系物 |
| B、三星烷的化学式为C9H12 |
| C、三星烷与丙苯互为同分异构体 |
| D、它们的一氯代物均只有两种 |
将10g10%NaOH溶液稀释成50mL,所得稀溶液中NaOH的物质的量浓度为( )
| A、0.02mol?L-1 |
| B、0.05mol?L-1 |
| C、0.25mol?L-1 |
| D、0.5mol?L-1 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、若5.6 LN2中含有N个氮分子,则阿伏加德罗常数为4N |
| B、1mol?L-1NaCl溶液含有NA个Na+离子 |
| C、14 g CO气体中所含的分子数为0.5NA |
| D、标准状况下,22.4 L CCl4含有的分子总数为NA |
比较两份质量相同的CH4和NH3,下列结论错误的是( )
| A、分子个数比为17:16 |
| B、原子个数比为16:17 |
| C、氢原子个数比为17:12 |
| D、相同状况下密度比为17:16 |