题目内容
如图是某研究性小组进行的两个实验(铁架台等辅助仪器略去未画).回答下列问题
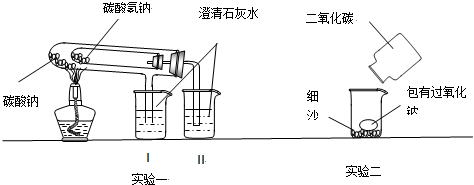
(1)实验一的两烧杯中可以观察到的实验现象是:I、 Ⅱ、 .
(2)实验二用来验证Na2O2与CO2的反应,观察到的实验现象是:含有Na2O2的棉花燃烧.由该实验可以得出许多结论,请写出你所得出的两个结论:
结论1: 结论2: .

(1)实验一的两烧杯中可以观察到的实验现象是:I、
(2)实验二用来验证Na2O2与CO2的反应,观察到的实验现象是:含有Na2O2的棉花燃烧.由该实验可以得出许多结论,请写出你所得出的两个结论:
结论1:
考点:探究碳酸钠与碳酸氢钠的性质,钠的重要化合物
专题:
分析:(1)碳酸氢钠不稳定,易分解,而碳酸钠不分解,由甲图可比较稳定性;
(2)包有Na2O2的棉花着火燃烧,则Na2O2与CO2的反应为放热反应,且生成氧气.
(2)包有Na2O2的棉花着火燃烧,则Na2O2与CO2的反应为放热反应,且生成氧气.
解答:
解:(1)碳酸氢钠不稳定,易分解,而碳酸钠不分解,则甲图中可观察到与小试管相连的烧杯Ⅱ中变浑浊,第一个烧杯无现象,则由甲图可比较二者的热稳定性,
故答案为:无明显现象;产生白色沉淀;
(2)包有Na2O2的棉花着火燃烧,则Na2O2与CO2的反应为放热反应,且生成氧气,则该反应为2Na2O2+2CO2═2Na2CO3+O2,说明反应能放出大量的热,
故答案为:过氧化钠和二氧化碳反应生成氧气;反应能放出大量的热.
故答案为:无明显现象;产生白色沉淀;
(2)包有Na2O2的棉花着火燃烧,则Na2O2与CO2的反应为放热反应,且生成氧气,则该反应为2Na2O2+2CO2═2Na2CO3+O2,说明反应能放出大量的热,
故答案为:过氧化钠和二氧化碳反应生成氧气;反应能放出大量的热.
点评:本题考查碳酸钠、碳酸氢钠、过氧化钠的性质实验,为高频考点,侧重热稳定性及过氧化钠与二氧化碳反应的考查,把握常见物质的性质及实验分析能力为解答的关键,题目难度不大.

练习册系列答案
相关题目
 在下列反应中:A2(g)+B2(g)?2AB(g)△H<0,当其达到平衡时,图象中曲线正确的是( )
在下列反应中:A2(g)+B2(g)?2AB(g)△H<0,当其达到平衡时,图象中曲线正确的是( )| A、① | B、② | C、③ | D、⑤ |
 海洋 中有丰富的食品、矿产、能源、药物和水产资源等(如图所示)下列说法不正确的是( )
海洋 中有丰富的食品、矿产、能源、药物和水产资源等(如图所示)下列说法不正确的是( )| A、在过程③⑤中溴元素均被氧化 |
| B、从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程 |
| C、过程②中结晶出的MgCl2?6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| D、过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为H2和O2的是( )
| A、稀NaOH溶液 |
| B、HCl溶液 |
| C、CuSO4溶液 |
| D、AgNO3溶液 |
将10g10%NaOH溶液稀释成50mL,所得稀溶液中NaOH的物质的量浓度为( )
| A、0.02mol?L-1 |
| B、0.05mol?L-1 |
| C、0.25mol?L-1 |
| D、0.5mol?L-1 |

 糖类、油脂和蛋白质在人类的生命活动过程中起重要作用,请根据糖类、油脂、蛋白质的有关性质回答下列问题:
糖类、油脂和蛋白质在人类的生命活动过程中起重要作用,请根据糖类、油脂、蛋白质的有关性质回答下列问题: