题目内容
(1)用稀硫酸浸泡由黄铜矿(主要成分CuFeS2)冶炼铜得到的滤渣,取少量所得溶液,滴加KSCN溶液后呈红色,则溶液中存在 (离子符号).
(2)铜在自然界存在于多种矿石中,如
请回答下列问题:
①上表所列铜化合物中,铜的质量百分含量最高的是 (填化学式).
②工业上以黄铜矿为原料,采用火法熔炼工艺生产铜.该工艺的中间过程会发生反应:2Cu2O+Cu2S
6Cu+SO2↑(Cu2S中S的化合价为-2),该反应的氧化剂是 .若此反应得到64克铜,则过程中转移的电子数 .
(2)铜在自然界存在于多种矿石中,如
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3?Cu(OH)2 |
①上表所列铜化合物中,铜的质量百分含量最高的是
②工业上以黄铜矿为原料,采用火法熔炼工艺生产铜.该工艺的中间过程会发生反应:2Cu2O+Cu2S
| ||
考点:氧化还原反应的计算,铜金属及其重要化合物的主要性质
专题:
分析:(1)用稀H2SO4浸泡熔渣,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;
(2)①铜化合物中,铜的质量百分含量=
,据此计算.
②反应2Cu2O+Cu2S
6Cu+SO2↑中,Cu元素化合价降低,S元素化合价升高,结合元素化合价变化判断.
(2)①铜化合物中,铜的质量百分含量=
| 铜的原子量×原子个数 |
| 分子量 |
②反应2Cu2O+Cu2S
| ||
解答:
解:(1)用稀H2SO4浸泡熔渣,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+,故答案为:Fe3+;
(2)①铜化合物中,铜的质量百分含量=
,黄铜矿中铜的含量=
=35%;
斑铜矿中铜的含量=
=63%;
辉铜矿中铜的含量=
=80%;
孔雀石中铜的含量=
=58%
所以铜的质量百分含量最高的是Cu2S.
故答案为:Cu2S;
②反应2Cu2O+Cu2S
6Cu+SO2↑中,Cu元素化合价由+1价降低到0价,S元素化合价由-2价升高到+4价,反应中Cu2O、Cu2S为氧化剂,Cu2S为还原剂,
由方程式可知,若生产6mol铜,则生产1molSO2,转移6mol电子,则生成64克铜,则过程中转移的电子数为NA,
故答案为:Cu2O、Cu2S;NA.
(2)①铜化合物中,铜的质量百分含量=
| 铜的原子量×原子个数 |
| 分子量 |
| 64 |
| 64+56+32×2 |
斑铜矿中铜的含量=
| 64×5 |
| 64×5+56+32×4 |
辉铜矿中铜的含量=
| 64×2 |
| 64×2+32 |
孔雀石中铜的含量=
| 64×2 |
| 64×2+12+16×5+1×2 |
所以铜的质量百分含量最高的是Cu2S.
故答案为:Cu2S;
②反应2Cu2O+Cu2S
| ||
由方程式可知,若生产6mol铜,则生产1molSO2,转移6mol电子,则生成64克铜,则过程中转移的电子数为NA,
故答案为:Cu2O、Cu2S;NA.
点评:本题考查氧化还原反应,为高考常见题型,侧重多元素化合价变化的氧化还原反应中电子转移数目的求解,把握元素的化合价变化即可解答,实验现象的判断,题目难度中等.

练习册系列答案
相关题目
下列实验现象和结论一致,正确的是( )
| A、氯水加入有色布条,有色布条褪色,说明溶液中有Cl2存在 |
| B、氯水溶液呈黄绿色,有刺激性气味,说明有Cl2存在 |
| C、氯水加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在 |
| D、氯水加入NaOH溶液,氯水黄绿色消失,说明有HClO存在 |
化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等.下列说法不正确的是( )
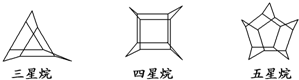

| A、它们之间互为同系物 |
| B、三星烷的化学式为C9H12 |
| C、三星烷与丙苯互为同分异构体 |
| D、它们的一氯代物均只有两种 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、若5.6 LN2中含有N个氮分子,则阿伏加德罗常数为4N |
| B、1mol?L-1NaCl溶液含有NA个Na+离子 |
| C、14 g CO气体中所含的分子数为0.5NA |
| D、标准状况下,22.4 L CCl4含有的分子总数为NA |
 糖类、油脂和蛋白质在人类的生命活动过程中起重要作用,请根据糖类、油脂、蛋白质的有关性质回答下列问题:
糖类、油脂和蛋白质在人类的生命活动过程中起重要作用,请根据糖类、油脂、蛋白质的有关性质回答下列问题: