题目内容
将浓度都为1mol/L的Na2CO3溶液和稀H2SO4按体积比2:1混合,则下列说法正确的是( )
| A、混合溶液的pH<7 |
| B、混合溶液中:c(SO42-)+c(OH-)<c(HCO3-)+c(H2CO3)+c(CO32-) |
| C、混合溶液中:c(Na+)+c(H+)<2[c(SO42-)+c(CO32-)] |
| D、混合溶液中离子浓度大小顺序是:c(Na+)>c(HCO3-)>c(OH-)>c(SO42-)>c(H+) |
考点:离子浓度大小的比较
专题:
分析:浓度都为1mol/L的Na2CO3溶液和稀H2SO4按体积比2:1混合,反应后溶液中的溶质为NaHCO3、Na2SO4,且碳酸氢钠的浓度为硫酸钠浓度的2倍,
A.由于碳酸氢根离子水解,溶液显示碱性;
B.根据物料守恒可得:2c(SO42-)=c(HCO3-)+c(H2CO3)+c(CO32-),由于氢氧根离子浓度较小,则c(SO42-)>>c(OH-);
C.根据电荷守恒2c(SO42-)+c(OH-)+c(HCO3-)+2c(CO32-)=c(H+)+c(Na+)判断;
D.溶液中钠离子浓度最大,由于碳酸氢根离子水解程度较小,则碳酸氢根离子能够等于硫酸根离子,氢氧根离子浓度较小,则c(SO42-)>>c(OH-),据此进行判断.
A.由于碳酸氢根离子水解,溶液显示碱性;
B.根据物料守恒可得:2c(SO42-)=c(HCO3-)+c(H2CO3)+c(CO32-),由于氢氧根离子浓度较小,则c(SO42-)>>c(OH-);
C.根据电荷守恒2c(SO42-)+c(OH-)+c(HCO3-)+2c(CO32-)=c(H+)+c(Na+)判断;
D.溶液中钠离子浓度最大,由于碳酸氢根离子水解程度较小,则碳酸氢根离子能够等于硫酸根离子,氢氧根离子浓度较小,则c(SO42-)>>c(OH-),据此进行判断.
解答:
解:浓度都为1mol/L的Na2CO3溶液和稀H2SO4按体积比2:1混合,反应后溶液中的溶质为NaHCO3、Na2SO4,且碳酸氢钠的浓度为硫酸钠浓度的2倍,
A.硫酸钠不水解,碳酸氢钠水解,溶液显示碱性,则溶液的pH>7,故A错误;
B.由于氢氧根离子主要为碳酸氢根离子水解生成的,其浓度较小,则c(SO42-)>>c(OH-),根据物料守恒2c(SO42-)=c(HCO3-)+c(H2CO3)+c(CO32-)可得:c(SO42-)+c(OH-)<c(HCO3-)+c(H2CO3)+c(CO32-),故B正确;
C.根据电荷守恒2c(SO42-)+c(OH-)+c(HCO3-)+2c(CO32-)=c(H+)+c(Na+)可得,c(Na+)+c(H+)>2[c(SO42-)+c(CO32-)],故C错误;
D.氢氧根离子主要为碳酸氢根离子水解生成的,其浓度较小,则c(SO42-)>>c(OH-),则溶液中正确的离子浓度大小顺序为:c(Na+)>c(HCO3-)>c(SO42-)>c(OH-)>c(H+),故D错误;
故选B.
A.硫酸钠不水解,碳酸氢钠水解,溶液显示碱性,则溶液的pH>7,故A错误;
B.由于氢氧根离子主要为碳酸氢根离子水解生成的,其浓度较小,则c(SO42-)>>c(OH-),根据物料守恒2c(SO42-)=c(HCO3-)+c(H2CO3)+c(CO32-)可得:c(SO42-)+c(OH-)<c(HCO3-)+c(H2CO3)+c(CO32-),故B正确;
C.根据电荷守恒2c(SO42-)+c(OH-)+c(HCO3-)+2c(CO32-)=c(H+)+c(Na+)可得,c(Na+)+c(H+)>2[c(SO42-)+c(CO32-)],故C错误;
D.氢氧根离子主要为碳酸氢根离子水解生成的,其浓度较小,则c(SO42-)>>c(OH-),则溶液中正确的离子浓度大小顺序为:c(Na+)>c(HCO3-)>c(SO42-)>c(OH-)>c(H+),故D错误;
故选B.
点评:本题考查了溶液中离子浓度大小比较,题目难度中等,根据题干反应物的量正确判断反应后溶质为解答关键,注意明确电荷守恒、物料守恒、盐的水解原理及其在判断离子浓度大小中的应用方法.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(固)+3B(气)?2C(气)+D(气)已达平衡状态的是(其中只有B气体有颜色)( )
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、气体的平均分子量 |
| D、气体的颜色 |
在标准状况下,将aLNH3完全溶于水得到VmL氨水,所得溶质的物质的量浓度为c mol/L.下列叙述中不正确的是( )
A、C=
| ||
B、已知常温下,氨水的电离常数为Ka,则pH约等于14+lg
| ||
| C、上述溶液中再加入0.5VmL同浓度稀盐酸,充分反应后c(Cl-)=c(NH4+)+c(NH3?H2O) | ||
| D、上述溶液中再加入VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
下列实验现象和结论一致,正确的是( )
| A、氯水加入有色布条,有色布条褪色,说明溶液中有Cl2存在 |
| B、氯水溶液呈黄绿色,有刺激性气味,说明有Cl2存在 |
| C、氯水加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在 |
| D、氯水加入NaOH溶液,氯水黄绿色消失,说明有HClO存在 |
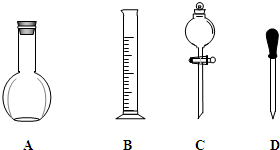 实验室需要0.1mol/L NaOH溶液 250mL.根据这种溶液的配制情况,回答下列问题.
实验室需要0.1mol/L NaOH溶液 250mL.根据这种溶液的配制情况,回答下列问题.