题目内容
2.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 电解精炼铜,当外电路通过NA个电子时;阳极质量减少32 g | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ•mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA | |
| C. | lmol•L1的氯化铜溶液中,若Cl-的数目为2Na,则Cu2+的数目为NA | |
| D. | 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA |
分析 A.电解精炼铜时,阳极上放电的除了铜,还有比铜活泼的金属杂质;
B.反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol转移6mol电子;
C.溶液体积未知;
D.一氧化氮和氧气反应生成二氧化氮,二氧化氮能转化为四氧化二氮.
解答 解:A.电解精炼铜时,阳极上放电的除了铜,还有比铜活泼的金属杂质,故当转移NA个电子时,阳极减少的质量小于32g,故A错误;
B.反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol转移6mol电子,放出热量9.2 kJ时,转移电子0.6 NA,故B正确;
C.溶液体积未知,无法计算氯离子、铜离子个数,故C错误;
D.标况下,一氧化氮和氧气反应生成二氧化氮,二氧化氮能自身转化为四氧化二氮导致混合气体的分子总数小于0.75NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大,注意电解法精炼铜的原理、注意二氧化二氮与四氧化二氮的转化.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA | |
| B. | 56gN2与CO混合物中原子总数是4NA | |
| C. | 标准状况下,44.8LNO与22.4LO2反应后的分子数是2NA | |
| D. | 常温下,1LpH=l的H2SO4溶液中的H+为0.2NA |
10.元素的电负性用来描述不同元素的原子对键合电子吸引力的大小.电负性应用:判断元素的金属性和非金属性的强弱.下表列出了同周期的几种短周期元素的部分性质
请回答下列问题:
(l)写出D元素的离子结构示意图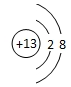 ;
;
(2)X的值应为D(填字母);
A.3.6 B.3.1 C.1.4 D.2.1
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系:同周期元素的原子半径越小,电负性越大;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:HCl>H2S>PH3(用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:Al(OH)3+3HClO4═Al(ClO4)3+3H2O.
请回答下列问题:
| 元素符号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
 ;
;(2)X的值应为D(填字母);
A.3.6 B.3.1 C.1.4 D.2.1
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系:同周期元素的原子半径越小,电负性越大;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:HCl>H2S>PH3(用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:Al(OH)3+3HClO4═Al(ClO4)3+3H2O.
17.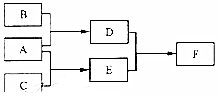 X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期,下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物,下列分析正确的是( )
X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期,下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物,下列分析正确的是( )
 X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期,下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物,下列分析正确的是( )
X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期,下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物,下列分析正确的是( )| A. | 离子半径:Y>Z | B. | Z的含氧酸均为强酸 | ||
| C. | 与Y同周期氰化物中D最稳定 | D. | F含离子键和共价键 |
7.下列各组澄清溶液中离子能大量共存,且加入(或滴入)X试剂后发生反应的离子方 程式书写正确的是( )
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | K+、Na+、ClO-、SO42- | 少量SO2 | SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S═2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、[Al(OH)4]- | 过量铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、Al3+ | 少量HCl | H++HCO3-═CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
14.研究电化学腐蚀及防护的装置如图所示.下列有关说法正确的是( )
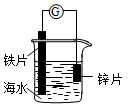

| A. | 锌片发生氧化反应作阴极 | |
| B. | 电子从铁片经过导线流向锌片 | |
| C. | 铁片上电极反应为:O2+2H2O+4e→4OH- | |
| D. | 该装置可用于研究外加电流阴极保护法 |
11.设NA为阿伏加德罗常数的数值.下列有关叙述不正确的是( )
| A. | 44g乙醛中所含的氧原子数为NA | |
| B. | 足量的铜与40mL 10mol/L硝酸反应,生成气体的分子数为0.2NA | |
| C. | 14g乙烯中所含的C-H 键数目为2NA | |
| D. | 0.1 mol NH3中所含的电子数为NA |
2.铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表:
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?合理(填“合理”或“不合理”).
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是B(填序号).
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入6mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
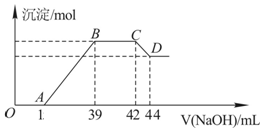
(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:8Fe+30H++3NO3-═8 Fe3++3NH4++9 H2O
(2)图中OA段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.
(3)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为NH4++OH-═NH3•H2O;
(4)熔融物中铝元素的物质的量为0.012mol.
(5)B点对应的沉淀的物质的量为0.048mol,A点对应的氢氧化钠溶液的体积为15mL.
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是B(填序号).
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入6mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:

(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:8Fe+30H++3NO3-═8 Fe3++3NH4++9 H2O
(2)图中OA段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.
(3)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为NH4++OH-═NH3•H2O;
(4)熔融物中铝元素的物质的量为0.012mol.
(5)B点对应的沉淀的物质的量为0.048mol,A点对应的氢氧化钠溶液的体积为15mL.