题目内容
12.写出下列反应的离子方程式:(1)AgNO3溶液与KCl溶液混合:Ag++Cl-=AgCl↓
(2)硫酸和氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
(3)氢氧化钠溶液与盐酸溶液混合:H++OH-=H2O
(4)锌投入硫酸铜溶液中:Zn+Cu2+=Zn2++Cu.
分析 (1)硝酸银与氯化钾溶液反应生成硝酸钾和氯化银沉淀;
(2)硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水;
(3)氢氧化钠溶液与盐酸反应生成氯化钠和水;
(4)锌与硫酸铜溶液反应生成硫酸锌和铜.
解答 解:(1)AgNO3溶液与KCl溶液混合,二者反应生成氯化银沉淀和硝酸钾,反应的离子方程式为:Ag++Cl-=AgCl↓,
故答案为:Ag++Cl-=AgCl↓
(2)硫酸和氢氧化钡溶液混合,二者反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(3)NaOH与盐酸发生中和反应生成NaCl和水,反应的离子方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O;
(4)锌投入硫酸铜溶液中,二者发生置换反应,反应的离子方程式为:Zn+Cu2+=Zn2++Cu,
故答案为:Zn+Cu2+=Zn2++Cu.
点评 本题考查了离子方程式的书写,为高考的高频题,属于中等难度的试题,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
10.下列离子与氖原子核外电子排布不相同的是( )
| A. | Na+ | B. | F- | C. | Al3+ | D. | S2- |
20.茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以检验某品牌茶叶中铁元素的存在并测定钙元素的质量分数 (已知CaC2O4为白色沉淀物质).首先取200g茶叶样品进行如图1操作:请回答下列有关问题: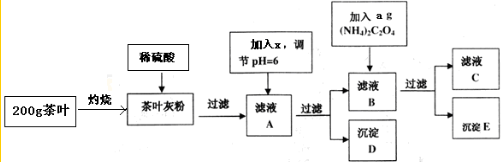
(1)①文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
②(NH4)3C2O4溶液显酸性
实验前要先将茶叶样品高温灼烧程灰粉,这部操作需要用到的实验仪器有:酒精灯、三脚架、玻璃棒、BC、其主要目的是使样品中的有机物完全分解.
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)从滤液A→沉淀D的过程中需要加入的物质X可以选择C
A.CaO B.Ca(OH)2 C.NH3•H2O
(3)用KMnO4标准溶液滴定C溶液时所发生的反应为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
现将滤液C稀释至250mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.10mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液体积如下表所示:
①此步操作过程中需要用到下列哪些仪器(如图)CDE(填写序号);
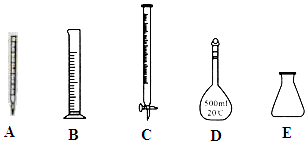
②滴定达到终点时的现象是滴入最后一滴KMnO4,溶液由无色变为紫色,且半分钟不恢复原色.
③为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,若不洗涤沉淀洗涤沉淀D,会使测定钙元素的含量偏低.(填“偏低”“偏高”、“无影响”,下同)若不洗涤沉淀E,会使测定钙元素的含量偏高.
④原茶叶中钙元素的质量分数为$\frac{\frac{a}{124}-0.05}{5}$.(用含a的代数式表示)
(4)设计最简单的实验检验茶叶中含有铁元素的操作和现象是:取少量的滤液A,滴入硫氰化钾溶液,溶液变成红色,证明溶液中存在铁离子,也证明离子茶叶中含有铁元素.

(1)①文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |
实验前要先将茶叶样品高温灼烧程灰粉,这部操作需要用到的实验仪器有:酒精灯、三脚架、玻璃棒、BC、其主要目的是使样品中的有机物完全分解.
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)从滤液A→沉淀D的过程中需要加入的物质X可以选择C
A.CaO B.Ca(OH)2 C.NH3•H2O
(3)用KMnO4标准溶液滴定C溶液时所发生的反应为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
现将滤液C稀释至250mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.10mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液体积如下表所示:
| 编号 | 终点时消耗KMnO4溶液体积(mL) |
| 1 | 19.98 |
| 2 | 22.00 |
| 3 | 20.02 |

②滴定达到终点时的现象是滴入最后一滴KMnO4,溶液由无色变为紫色,且半分钟不恢复原色.
③为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,若不洗涤沉淀洗涤沉淀D,会使测定钙元素的含量偏低.(填“偏低”“偏高”、“无影响”,下同)若不洗涤沉淀E,会使测定钙元素的含量偏高.
④原茶叶中钙元素的质量分数为$\frac{\frac{a}{124}-0.05}{5}$.(用含a的代数式表示)
(4)设计最简单的实验检验茶叶中含有铁元素的操作和现象是:取少量的滤液A,滴入硫氰化钾溶液,溶液变成红色,证明溶液中存在铁离子,也证明离子茶叶中含有铁元素.
17.硬铝合金广泛用于现代社会.下列关于硬铝的说法中,错误的是( )
| A. | 硬铝的密度约为钢材的三分之一,是适合于做飞行器的材料 | |
| B. | 硬铝的强度比铝大得多,铝材比钢材的某些性能要好 | |
| C. | 硬铝的熔点跟铝相比有一定的提高,常被用于炊具 | |
| D. | 硬铝的抗腐蚀性较强,常被用于制门窗框架 |
4.电化学在日常生活中用途广泛,图甲是镁--次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理.下列说法正确的是( )
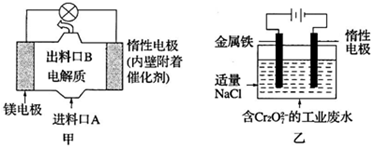

| A. | 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 | |
| B. | 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓ | |
| C. | 图乙电解池中,若有0.84g阳极材料参与反应,则阴极会有3.36L的气体产生 | |
| D. | 若图甲燃料电池消耗0.36g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀 |
2.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 电解精炼铜,当外电路通过NA个电子时;阳极质量减少32 g | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ•mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA | |
| C. | lmol•L1的氯化铜溶液中,若Cl-的数目为2Na,则Cu2+的数目为NA | |
| D. | 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA |
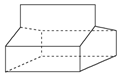 按要求回答问题:
按要求回答问题: ;
;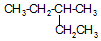 的系统命名为3-甲基戊烷.
的系统命名为3-甲基戊烷. .
. ,如果要合成
,如果要合成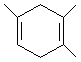 ,所用的原料可以是
,所用的原料可以是