题目内容
将0.02molCl2缓缓通入100mL0.2mol/L的FeI2溶液中,此过程中溶液的c(Fe3+)或c(I-)与Cl2的物质的量的关系如图所示(溶液的体积视为不变),正确的是( )
A、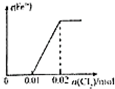 |
B、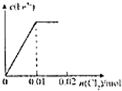 |
C、 |
D、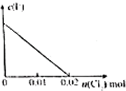 |
考点:离子方程式的有关计算,氯气的化学性质
专题:
分析:二价铁离子与碘离子都具有还原性,但是碘根离子还原性强于二价铁离子,通入氯气后,氯气首先氧化碘离子为碘单质,然后再氧化二价铁离子为三价铁离子,据此解答.
解答:
100mL0.2mol/L的FeI2溶液中,含有二价铁离子物质的量为0.02mol,含有碘离子的物质的量为0.04mol,通入氯气后,依次发生反应:2I-+Cl2=2Cl-+I2;2Fe2++Cl2=2Fe3++2Cl-,依据方程式得:
2I-+Cl2=2Cl-+I2;
2 1
0.04mol 0.02mol
2Fe2++Cl2=2Fe3++2Cl-,
2 1
0.02mol 0.01mol
A.通入氯气后,氯气首先氧化碘离子为碘单质,然后再氧化二价铁离子为三价铁离子,当通入氯气0.02mol时才开始出现三价铁离子,故A错误;
B.通入氯气后,氯气首先氧化碘离子为碘单质,然后再氧化二价铁离子为三价铁离子,当通入氯气0.02mol时才开始出现三价铁离子,故B错误;
C.通入氯气后,氯气首先氧化碘离子为碘单质,所以碘离子浓度随着通入氯气的物质的量增加而减少,故C错误;
D.通入氯气后,氯气首先氧化碘离子为碘单质,然后再氧化二价铁离子为三价铁离子,当通入氯气0.02mol,碘离子完全反应生成单质碘,碘离子浓度为0,故D正确;
故选:D.
2I-+Cl2=2Cl-+I2;
2 1
0.04mol 0.02mol
2Fe2++Cl2=2Fe3++2Cl-,
2 1
0.02mol 0.01mol
A.通入氯气后,氯气首先氧化碘离子为碘单质,然后再氧化二价铁离子为三价铁离子,当通入氯气0.02mol时才开始出现三价铁离子,故A错误;
B.通入氯气后,氯气首先氧化碘离子为碘单质,然后再氧化二价铁离子为三价铁离子,当通入氯气0.02mol时才开始出现三价铁离子,故B错误;
C.通入氯气后,氯气首先氧化碘离子为碘单质,所以碘离子浓度随着通入氯气的物质的量增加而减少,故C错误;
D.通入氯气后,氯气首先氧化碘离子为碘单质,然后再氧化二价铁离子为三价铁离子,当通入氯气0.02mol,碘离子完全反应生成单质碘,碘离子浓度为0,故D正确;
故选:D.
点评:本题考查了有关离子反应图象,明确二价铁离子与碘离子还原性强弱是解题关键,题目难度中等.

练习册系列答案
相关题目
对H2O的电离平衡不产生影响的粒子是( )
| A、Na2O2 |
| B、26M3+ |
C、 |
D、 |
下列说法正确的是( )
| A、C4H8O2的同分异构体中能与NaOH反应的有5种 |
| B、等质量的有机物完全燃烧后生成的CO2的量相同,则这两种有机物的实验式一定相同 |
| C、石蜡油分解的实验中,碎瓷片的作用是催化作用和积蓄热量产生高温 |
| D、将甲烷与氯气的混合气体置于密闭容器中放置光亮的地方,一段时间后,装置内的气体有甲烷、氯气、氯化氢、一氯甲烷,二氯甲烷 |

 将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:
将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答: 甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.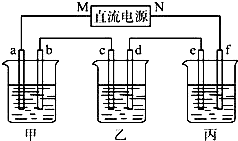 如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.
如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.