题目内容
已知NA为阿佛加德罗常数,下列有关叙述中正确的是( )
| A、已知有2mol Na218O2与足量的CO2充分反应,生成的碳酸钠中含18O的原子为NA个 |
| B、电解精炼镍时,当电源提供NA个电子时,阳极溶解的Ni2+应为0.5mol |
| C、标准状况下,22.4L SO2和O2的混合气体中含有的氧原子数为2NA |
| D、向足量MnO2中加入溶有4mol HCl的浓盐酸,加热,反应后的溶液中的Cl-数是2NA个(不考虑盐酸的挥发) |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据过氧化钠和二氧化碳反应的化学方程式分析计算;
B、阳极是含有杂质的粗镍,其中铁、锌等也失电子;
C、依据n=
计算物质的量,二氧化硫和氧气含有氧原子数相同计算分析;
D、浓盐酸随反应进行浓度变稀后不再与二氧化锰反应.
B、阳极是含有杂质的粗镍,其中铁、锌等也失电子;
C、依据n=
| V |
| 22.4 |
D、浓盐酸随反应进行浓度变稀后不再与二氧化锰反应.
解答:
解:A、依据过氧化钠和二氧化碳反应的化学方程式分析计算,2Na2O2+2CO2=2Na2CO3+O2,2mol Na218O2与足量的CO2充分反应,生成的碳酸钠中含18O的原子为2NA个,故A错误;
B、阳极是含有杂质的粗镍,其中铁、锌等也失电子,当电源提供NA个电子时,阳极溶解的Ni2+应小于0.5mol,故B错误;
C、依据n=
计算物质的量=
=1mol,二氧化硫和氧气含有氧原子数相同,22.4L SO2和O2的混合气体中含有的氧原子数为2NA,故C正确;
D、浓盐酸随反应进行浓度变稀后不再与二氧化锰反应,反应后的溶液中的Cl-数小于2NA个,故D错误;
故选C.
B、阳极是含有杂质的粗镍,其中铁、锌等也失电子,当电源提供NA个电子时,阳极溶解的Ni2+应小于0.5mol,故B错误;
C、依据n=
| V |
| 22.4 |
| 22.4L |
| 22.4L/mol |
D、浓盐酸随反应进行浓度变稀后不再与二氧化锰反应,反应后的溶液中的Cl-数小于2NA个,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是氧化还原反应电子转移,气体摩尔体积条件应用,电解原理分析,注意浓盐酸随反应进行变为稀盐酸不予二氧化锰反应生成氯气,题目较简单.

练习册系列答案
相关题目
下列各组离子在指定溶液中一定能大量共存的是( )
| A、使甲基橙变红色的溶液:Mg 2+、K+、SO4 2-、NO3- |
| B、PH=13的溶液:Na+、Cu 2+、HCO3-、NO3- |
| C、水电离出的c(H+)=10-12 mol/L的溶液:K+、Na+、CO3 2-、Br- |
| D、0.1mol/L的AgNO3的溶液:H+、K+、SO4 2-、I- |
在标准状况下,将O2与NO2按1:4的体积比充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面逐渐上升后,最后烧瓶内溶液的物质的量浓度为( )
| A、0.045mol?L-1 |
| B、0.036mol?L-1 |
| C、0.026mol?L-1 |
| D、0.030mol?L-1 |
下列离子方程式与所述事实相符且正确的是( )
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| B、Ca(HCO3)2溶液中加入足量NaOH溶液:HCO3-+OH-=H2O+CO32- |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| D、氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
对H2O的电离平衡不产生影响的粒子是( )
| A、Na2O2 |
| B、26M3+ |
C、 |
D、 |

 ;
;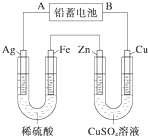 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4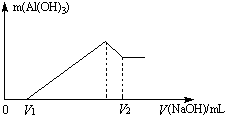 将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:
将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答: