题目内容
在250g溴化钾的溶液中通入一定量干燥的氯气,待反应完全后,把溶液蒸干,剩余物经干燥后为40g.经分析知固体中含20%的化合态溴.求:
(1)原溴化钾溶液中溶质的物质的量浓度(溴化钾溶液密度为1.01g/cm3).
(2)在标准状况下,通入多少体积Cl2可使原溶液中KBr全部氧化?
(1)原溴化钾溶液中溶质的物质的量浓度(溴化钾溶液密度为1.01g/cm3).
(2)在标准状况下,通入多少体积Cl2可使原溶液中KBr全部氧化?
考点:氧化还原反应的计算,化学方程式的有关计算
专题:计算题
分析:(1)剩余固体中含有20%的化合态溴,则KBr没有完全反应,氯气量不足,剩余固体中m(KBr)=
=11.9g,KCl的质量=40g-11.9g=28.1g,根据Cl2+2KBr=Br2+2KCl中KCl~KBr得参加反应的m(KBr)=
×119=44.88g,则原来溶液中m(KBr)=11.9g+44.88g=56.78g,
n(KBr)=
=0.477mol,
溶液体积=
=0.2475L,根据C=
计算溶液物质的量浓度;
(2)原来溶液中n(KBr)=0.477mol,根据Cl2+2KBr=Br2+2KCl得n(Cl2)=
n(KBr),再根据V=nVm计算氯气体积.
| 40g×20% | ||
|
| 28.1g |
| 74.5 |
n(KBr)=
| 56.78g |
| 119g/mol |
溶液体积=
| 250g |
| 1.01×103g/L |
| n |
| V |
(2)原来溶液中n(KBr)=0.477mol,根据Cl2+2KBr=Br2+2KCl得n(Cl2)=
| 1 |
| 2 |
解答:
解:(1)剩余固体中含有20%的化合态溴,则KBr没有完全反应,氯气量不足,剩余固体中m(KBr)=
=11.9g,KCl的质量=40g-11.9g=28.1g,根据Cl2+2KBr=Br2+2KCl中KCl~KBr得参加反应的m(KBr)=
×119=44.88g,则原来溶液中m(KBr)=11.9g+44.88g=56.78g,
n(KBr)=
=0.477mol,
溶液体积=
=0.2475L,
溶液中C(KBr)=
=
=1.9mol/L,
答:原溴化钾溶液中溶质的物质的量浓度为1.9mol/L;
(2)原来溶液中n(KBr)=0.477mol,根据Cl2+2KBr=Br2+2KCl得n(Cl2)=
n(KBr),则V(Cl2)=
n(KBr)×22.4L/mol=
×0.477mol×22.4L/mol=5.3L,
答:在标准状况下,通入5.3LCl2可使原溶液中KBr全部氧化.
| 40g×20% | ||
|
| 28.1g |
| 74.5 |
n(KBr)=
| 56.78g |
| 119g/mol |
溶液体积=
| 250g |
| 1.01×103g/L |
溶液中C(KBr)=
| n |
| V |
| 0.477mol |
| 0.2475L |
答:原溴化钾溶液中溶质的物质的量浓度为1.9mol/L;
(2)原来溶液中n(KBr)=0.477mol,根据Cl2+2KBr=Br2+2KCl得n(Cl2)=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
答:在标准状况下,通入5.3LCl2可使原溶液中KBr全部氧化.
点评:本题考查氧化还原反应的计算,侧重考查分析、计算能力,注意原来溶液中KBr未完全被氧化,再利用物质的量公式中各个物理量之间的关系式进行计算即可,题目难度不大.

练习册系列答案
相关题目
对H2O的电离平衡不产生影响的粒子是( )
| A、Na2O2 |
| B、26M3+ |
C、 |
D、 |
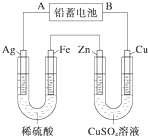 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
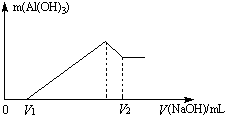 将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:
将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答: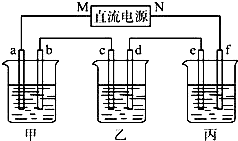 如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.
如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.