题目内容
19.向下列溶液中通入氯气,现象和结论描述正确的是( )| A. | 品红溶液:红色褪去,加热该褪色溶液,仍无色:氯气具有漂白性 | |
| B. | 紫色石蕊溶液:先变红,后褪色;氯气与水反应生成盐酸和次氯酸 | |
| C. | 含酚酞的氢氧化钠溶液:红色褪去;氯气只作氧化剂 | |
| D. | 硫化钠溶液:溶液变浑浊;氯气只作还原剂 |
分析 A.次氯酸具有漂白性,氯气不具有漂白性;
B.氯气溶于水与水反应生成盐酸和次氯酸;
C.依据氯气与氢氧化钠反应中氯元素化合价变化判断;
D.氯气与硫化钠反应生成硫单质和氯化钠,氯元素化合价降低.
解答 解:A.氯气通入品红溶液中红色褪去,加热该褪色溶液,仍无色,因次氯酸具有漂白性,故A错误;
B.氯气溶于水与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,所以紫色石蕊溶液:先变红,后褪色,故B正确;
C.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,氯元素部分化合价升高、部分降低,氯气既表现氧化性又表现还原性,故C错误;
D.硫化钠溶液:溶液变浑浊;氯气只作氧化剂,故D错误;
故选:B.
点评 本题考查了氯气的性质,熟悉氯气的性质,明确氧化还原反应基本概念是解题关键,题目难度不大.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
9.下列物质中属 于共价化合物的是( )
| A. | Na2O | B. | NaCl | C. | H2O | D. | NaOH |
10.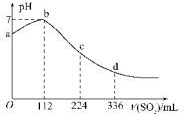 标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
 标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )| A. | 亚硫酸是比氢硫酸更弱的酸 | |
| B. | ab段反应是:SO2+2H2S═3S↓+2H2O | |
| C. | 原H2S溶液的物质的量浓度为0.05 mol/L | |
| D. | b点对应的溶液导电性最强 |
7.将铁片加到1L0.5mol/L的氯化铁溶液中,当铁离子和亚铁离子的浓度相同时,铁片的质量减少了( )
| A. | 1.4g | B. | 2.8g | C. | 5.6g | D. | 11.2g |
14.根据某种化学性质,可将CO2、P2O5、SO2归为一类,下列物质中,完全符合此共性而能归为此类物质的是( )
| A. | CaO | B. | CO | C. | SiO2 | D. | H2O |