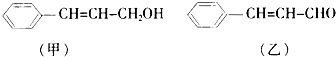题目内容
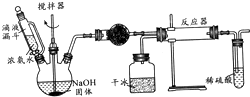 实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.(1)写出加入药品之前实验操作的要点
(2)干燥管中盛放的药品是
(3)对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有
(4)有同学认为该实验装置存在安全问题,请问可能面临的安全问题是
(5)氨基甲酸铵可用作肥料,其肥效比尿素:
考点:制备实验方案的设计
专题:实验设计题
分析:(1)分析装置图可知,气体分压过程制备物质,需要组装好检验装置气密性;有水会和氨气、二氧化碳反应生成碳酸氢钠;
(2)反应物氨气必须是干燥的,需要用碱性干燥剂干燥,如碱石灰、固体氢氧化钠或氧化钙等;利用固体氢氧化钠或碱石灰或氧化钙固体溶解放热分析;
(3)干冰制取的二氧化碳中不含杂质,不需要干燥;该反应为放热反应,干冰变为二氧化碳吸收热量,有利于增大反应物转化率;
(4)依据装置图中流程分析,安全问题主要是堵塞导气管,液体发生倒吸;依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸;
(5)氨基甲酸铵可用作肥料,其肥效和尿素比,依据氮元素含量分析;碳酸氢铵的氨基甲酸铵样品中,使碳元素完全转化为碳酸钙,依据碳元素守恒和混合物质量计算物质的量分数.
(2)反应物氨气必须是干燥的,需要用碱性干燥剂干燥,如碱石灰、固体氢氧化钠或氧化钙等;利用固体氢氧化钠或碱石灰或氧化钙固体溶解放热分析;
(3)干冰制取的二氧化碳中不含杂质,不需要干燥;该反应为放热反应,干冰变为二氧化碳吸收热量,有利于增大反应物转化率;
(4)依据装置图中流程分析,安全问题主要是堵塞导气管,液体发生倒吸;依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸;
(5)氨基甲酸铵可用作肥料,其肥效和尿素比,依据氮元素含量分析;碳酸氢铵的氨基甲酸铵样品中,使碳元素完全转化为碳酸钙,依据碳元素守恒和混合物质量计算物质的量分数.
解答:
解:(1)分析装置图可知,气体分压过程制备物质,需要组装好检验装置气密性;有水会和氨气、二氧化碳反应生成碳酸氢钠,反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;
故答案为:按图所示组装仪器,检查装置气密性,NH3+CO2+H2O=NH4HCO3;
(2)由于制备氨基甲酸铵的原料氨气必须是干燥的,以防止副反应的发生,因此生成的氨气必须进行干燥,因为氨气是碱性气体,所以干燥氨气应该用氧化钙或固体氢氧化钠或碱石灰,固体氢氧化钠遇水放出大量热,温度升高,有利于氨气逸出,同时C(OH-)浓度增大,氨水的电离平衡左移,放出氨气;
故答案为:氧化钙或固体氢氧化钠或碱石灰;固体氢氧化钠遇水放出大量热,温度升高,有利于氨气逸出,同时C(OH-)浓度增大,氨水的电离平衡左移,放出氨气;
(3)碳酸盐和酸反应制CO2,则生成的CO2必须进行净化和干燥处理,而直接利用干冰制备CO2,不需要干燥;又因为该反应是放热反应,提供低温环境,可以提高转化率,
故答案为:不需要干燥;提供低温环境,提高转化率;
(4)依据装置图中流程分析,安全问题主要是堵塞导气管,液体发生倒吸;依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸,实验装置存在安全问题产品易堵塞导管,稀硫酸会倒吸;
故答案为:产品易堵塞导管,稀硫酸会倒吸;
(5)氨基甲酸铵可用作肥料,含氮量=
×100%=35.9%,尿素含氮量=46.7%,所以其肥效比尿素低;
取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.物质的量为0.010mol,设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,依据碳元素守恒得到;
x+y=0.01
78x+79y=0.7830
解得x=0.007mol
y=0.0023ol
则样品中氨基甲酸铵的物质的量分数=
×100%=70%,故答案为:70%;
故答案为:低,70%;
故答案为:按图所示组装仪器,检查装置气密性,NH3+CO2+H2O=NH4HCO3;
(2)由于制备氨基甲酸铵的原料氨气必须是干燥的,以防止副反应的发生,因此生成的氨气必须进行干燥,因为氨气是碱性气体,所以干燥氨气应该用氧化钙或固体氢氧化钠或碱石灰,固体氢氧化钠遇水放出大量热,温度升高,有利于氨气逸出,同时C(OH-)浓度增大,氨水的电离平衡左移,放出氨气;
故答案为:氧化钙或固体氢氧化钠或碱石灰;固体氢氧化钠遇水放出大量热,温度升高,有利于氨气逸出,同时C(OH-)浓度增大,氨水的电离平衡左移,放出氨气;
(3)碳酸盐和酸反应制CO2,则生成的CO2必须进行净化和干燥处理,而直接利用干冰制备CO2,不需要干燥;又因为该反应是放热反应,提供低温环境,可以提高转化率,
故答案为:不需要干燥;提供低温环境,提高转化率;
(4)依据装置图中流程分析,安全问题主要是堵塞导气管,液体发生倒吸;依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸,实验装置存在安全问题产品易堵塞导管,稀硫酸会倒吸;
故答案为:产品易堵塞导管,稀硫酸会倒吸;
(5)氨基甲酸铵可用作肥料,含氮量=
| 2×14 |
| 78 |
取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.物质的量为0.010mol,设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,依据碳元素守恒得到;
x+y=0.01
78x+79y=0.7830
解得x=0.007mol
y=0.0023ol
则样品中氨基甲酸铵的物质的量分数=
| 0.007mol |
| 0.01mol |
故答案为:低,70%;
点评:本题考查了物质制备实验的设计应用,主要是氨气的制备方法,氨基甲酸的制备实验装置分析判断,实验基本操作,混合物分离的实验设计,有关混合物的计算,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、pH相等的下列溶液①(NH4)2SO4、②NH4HSO4、③NH4Cl,c(NH4+)的大小关系为①=③>② |
| B、0.1mol/L的NaHA溶液,若pH=4,则溶液中存在:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| C、在NaHCO3和Na2CO3的混合溶液中一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D、在物质的量浓度之比为1:2的NaClO、NaHCO3的混合溶液中一定存在:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
在含有Cu(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入铁粉,经充分反应后铁粉完全溶解,过滤、洗涤、干燥得固体产物12.4g,则溶解的铁粉的质量是( )
| A、5.6 g |
| B、7 g |
| C、2.8 g |
| D、8.4 g |

 ,请设计合成路线(无机试剂及溶剂任选).
,请设计合成路线(无机试剂及溶剂任选).



 为镁元素的某种粒子结构示意图,该图表示(填序号)
为镁元素的某种粒子结构示意图,该图表示(填序号)